 |
Главная |
Лекция 1. Модели атома. Опыты Резерфорда
|
из
5.00
|
КОНСПЕКТ ЛЕКЦИЙ
ФИЗИКА АТОМОВ И АТОМНЫХ ЯВЛЕНИЙ
Лекция 1. Модели атома. Опыты Резерфорда.
В опытах Резерфорда использовались потоки заряженных частиц -  –лучи. Это пучок двукратно ионизованных атомов гелия. Опираясь на опыты по рассеянию
–лучи. Это пучок двукратно ионизованных атомов гелия. Опираясь на опыты по рассеянию  –частиц, Резерфорд пришел к ядерной модели атома:положительный заряд атома сосредоточен в его центре в небольшой области с размерами порядка
–частиц, Резерфорд пришел к ядерной модели атома:положительный заряд атома сосредоточен в его центре в небольшой области с размерами порядка  см. Теория рассеяния альфа–частиц атомами вещества на основе упрощенной задачи двух тел с центральным взаимодействием. Это взаимодействие, по предположению, описывается кулоновской силой отталкивания между ядром и
см. Теория рассеяния альфа–частиц атомами вещества на основе упрощенной задачи двух тел с центральным взаимодействием. Это взаимодействие, по предположению, описывается кулоновской силой отталкивания между ядром и  –частицей. Траектория
–частицей. Траектория 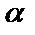 – частицы гипербола, вид которой зависит от прицельного параметра b (рис.1.1).
– частицы гипербола, вид которой зависит от прицельного параметра b (рис.1.1).

Рис.1.1
Угол рассеяния  и прицельный параметр связаны формулой:
и прицельный параметр связаны формулой:
 . (1.1)
. (1.1)
M – масса альфа–частицы, 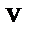 –еескорость на бесконечно большом удалении от ядра, Ze – заряд ядра. Заряд альфа–частицы 2e.
–еескорость на бесконечно большом удалении от ядра, Ze – заряд ядра. Заряд альфа–частицы 2e.
Рассеяние частиц характеризуется дифференциальным сечением  .По определению,
.По определению,
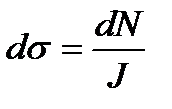 , (1.2)
, (1.2)
 – число частиц, рассеянных в единицу времени в элемент телесного угла
– число частиц, рассеянных в единицу времени в элемент телесного угла  (рис.1.1),
(рис.1.1),  – плотность потока падающих частиц. Картина рассеяния симметрична в плоскости, перпендикулярной плоскости рисунка. В этой плоскости изменению прицельного параметра от b до b+db соответствует кольцо шириной db. Частицы, «метящие» в это кольцо как в «мишень», будут рассеиваться в области с углами рассеяния в интервале
– плотность потока падающих частиц. Картина рассеяния симметрична в плоскости, перпендикулярной плоскости рисунка. В этой плоскости изменению прицельного параметра от b до b+db соответствует кольцо шириной db. Частицы, «метящие» в это кольцо как в «мишень», будут рассеиваться в области с углами рассеяния в интервале  ,
,  . Площадь кольца определяет дифференциальное сечение рассеяния:
. Площадь кольца определяет дифференциальное сечение рассеяния:
 . (1.3)
. (1.3)
Используя (1.1), получаем формулу Резерфорда:
 , (1.4)
, (1.4)
 d
d 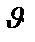 – элемент телесного угла. Формулой (1.4) объясняются экспериментальные факты, которые привели Резерфорда к открытию ядерной модели атома.
– элемент телесного угла. Формулой (1.4) объясняются экспериментальные факты, которые привели Резерфорда к открытию ядерной модели атома.
Формула Резерфорда непосредственно проверялась в эксперименте. Использовались очень тонкие металлические пленки - фольги толщиной  Формула (1.4) описывает рассеяние
Формула (1.4) описывает рассеяние  – частиц одним ядром. Если в рассеивающей фольге плотность ядер равна n, то их общее число nV, где V –объем фольги. Число рассеянных
– частиц одним ядром. Если в рассеивающей фольге плотность ядер равна n, то их общее число nV, где V –объем фольги. Число рассеянных 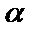 –частиц в единицу времени:
–частиц в единицу времени:
 . (1.5)
. (1.5)
Отсюда:
 . (1.6)
. (1.6)
В условиях эксперимента все величины в правой части формулы (1.6) неизменны. Тогда произведение  должно быть постоянным. Это проверялось на опыте Гейгером и Марсденом (1913). Схема их установки изображена на рис.1.2.
должно быть постоянным. Это проверялось на опыте Гейгером и Марсденом (1913). Схема их установки изображена на рис.1.2.
Расхождения опытных данных с формулой (1.6):
- при очень малых углах рассеяния (большие прицельные параметры) - эффект экранировки кулоновского поля ядра атомными электронами.
- когда прицельный параметр становится меньше  см (или при достаточно большой энергии
см (или при достаточно большой энергии  – частиц) - действие ядерных сил, имеющих характер короткодействующих сил притяжения и не зависящих от заряда частиц. Оценка радиуса действия ядерных сил (радиуса ядра атома).
– частиц) - действие ядерных сил, имеющих характер короткодействующих сил притяжения и не зависящих от заряда частиц. Оценка радиуса действия ядерных сил (радиуса ядра атома).
- при рассеянии альфа–частиц по разным направлениям легкими элементами («аномальное» рассеяние α–частиц) - в случае легких элементов, заряд ядра которых сравнительно невелик, силы отталкивания являются слабыми, так что α–частицы могут близко подходить к ядру, и, возможно, даже проникать в него. Резерфорд - возможность расщепления атомных ядер с помощью быстрых α–частиц.
Проверка формулы Резерфорда другим методом. Блэккет - рассеяние  –частиц в газах с помощью камеры Вильсона (получено большое количество фотографий треков
–частиц в газах с помощью камеры Вильсона (получено большое количество фотографий треков  –частиц в различных газах, что позволило изучить границы применимости закона Кулона(1785), лежащего в основе формулы Резерфорда.).
–частиц в различных газах, что позволило изучить границы применимости закона Кулона(1785), лежащего в основе формулы Резерфорда.).
 По формуле (1.6) можно также найти число Z (Чэдвик,1920). Надо фиксировать все величины, кроме
По формуле (1.6) можно также найти число Z (Чэдвик,1920). Надо фиксировать все величины, кроме  Трудность: величины
Трудность: величины  и J сильно отличаются друг от друга
и J сильно отличаются друг от друга
Основные предположения, при которых получена формула Резерфорда:
1) В центре атома находится ядро с размерами  . Число Z, определяющее заряд ядра, совпадает с порядковым номером атома в периодической системе элементов. Электроны атома обращаются вокруг ядра, как планеты вокруг Солнца;
. Число Z, определяющее заряд ядра, совпадает с порядковым номером атома в периодической системе элементов. Электроны атома обращаются вокруг ядра, как планеты вокруг Солнца;
2) закон Кулона описывает взаимодействие между точечными зарядами также и на атомных расстояниях.
Принципиальные недостатки ядерной модели атома Резерфорда:
1) ни эксперименты, ни теория Резерфорда не позволяют оценить размеры атома (порядка  ). Из фундаментальных постоянных в этой модели –
). Из фундаментальных постоянных в этой модели –  (масса ядра), нельзя составить величину с размерностью длины.
(масса ядра), нельзя составить величину с размерностью длины.
2) планетарная модель противоречит факту существования атома. Траекторией электрона должна быть скручивающаяся спираль, оканчивающаяся «падением» электрона на ядро за время порядка  с.
с.
3) планетарная модель не объясняет спектральных закономерностей излучения атомов.
|
из
5.00
|
Обсуждение в статье: Лекция 1. Модели атома. Опыты Резерфорда |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

