 |
Главная |
Строение атома. Зависимость свойств элементов от строения их электронных оболочек.
|
из
5.00
|
План лекции:
1. Ядерная модель строения атома.
2. Уравнение Шредингера. Квантовые числа электрона.
3. Правила распределения электронов в атомах.
4. Зависимость свойств элементов от строения их электронных оболочек.
В 1909 году уже существовала модель атома, предложенная английским ученым Д.Д.Томсоном. По ней атом представлялся в виде облака положительного заряда, в котором находятся отрицательно заряженные электроны, подобно семечкам в арбузе. Но уже через год в 1910 году сотрудники другого английского ученого Э.Резерфорда выполнили эксперимент, который заставил отказаться от модели атома Д.Д.Томсона. Родилась ядерная модель строения атома. Согласно этой модели атом состоит из ядра, в котором сосредоточен положительный заряд и почти вся масса атома; ядро занимает очень маленький объем атома, а вокруг него вращаются электроны, количество которых полностью уравновешивает положительный заряд ядра, так как атом в целом электрически нейтрален.
В 1913 году в лаборатории Э.Резерфорда его ученик Г.Мозли нашел способ измерения чисел единичных положительных зарядов в атомных ядрах элементов, которые оказались равными их порядковым номерам в Периодической системе элементов Д.И.Менделеева. Его открытие явилось неопровержимым доказательством правильности размещения элементов в Периодической системе Д.И.Менделеева и содействовало выяснению физического смысла порядкового номера элемента – Z, который Г.Мозги назвал также атомным номером. Так как атомы электрически нейтральны, то атомный номер каждого элемента показывает не только величину положительного заряда его ядра (в относительных единицах), но и количество электронов в атоме.
В 1919 - 1920 годах Э.Резерфорд экспериментально наблюдал ядра водорода, выбитые a-частицами из ядер атомов других элементов. Он же ввел термин “протон” в качестве названия ядра атома водорода. Протон имеет массу (mp) 1,67 × 10-27 кг или mp @ 1836 mе и положительный электрический заряд, равный по абсолютной величине заряду электрона: е =1,6 × 10-19 Кл, относительный заряд + 1. Его символ – р. Однако указанная гипотеза имела два противоречия. Во-первых, массы ядер атомов элементов больше суммарных масс протонов в них (за исключением водорода). Во-вторых, непонятно, какими силами в ядрах удерживаются вместе положительно заряженные частицы. Для устранения этих противоречий было выдвинуто предположение о том, что в ядрах кроме протонов имеются такие же по массе, но нейтральные по электрическому заряду частицы. Их назвали нейтронами. Нейтроны и протоны называют также нуклонами. Между любыми из них действуют более мощные по сравнению с электрическими силами ядерные силы притяжения. Существование нейтрона установил в 1932 году английский физик, ученик Э.Резерфорда Д.Чедвик. Символ нейтрона - n, его масса 1,67 × 10-27 кг или mn @ 1840 mе, заряд равен нулю.
Один из квантовомеханических подходов для описания атома базируется на уравнении австрийского физика Э.Шредингера, выведенном им в 1926 году в рамках волновой механики:
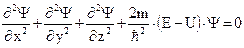 , (2.3)
, (2.3)
где m - масса частицы, находящейся в поле с потенциалом U, движение которой описывается (2.3); Е - полная энергия частицы; ħ = h/ 2p, где h – постоянная Планка (h=6,63·10-34Дж·с. Это элементарный квант действия.); Y - волновая функция или волновое уравнение; x, y, z – координаты. Как видно по (2.3), уравнение Шредингера является дифференциальным уравнением. Оно описывает, в частности, электронную волну в атоме и учитывает как притяжение электрона к ядру (U), так и кинетическую энергию электрона (E – U). Его точные решения получены всего для нескольких случаев, но приближенные решения удалось получить даже для сложных многоэлектронных атомов.
Рассмотрим один из методов решения (2.3) – это метод разделения переменных, используемый обычно при решении подобных уравнений. Исходное уравнение, содержащее четыре переменные, преобразуют так, чтобы в одной из его частей оставалась всего одна переменная, после чего обе части приравнивают к некоторой постоянной величине. Получают два уравнения, первое с одной переменной, второе с тремя переменными. Далее второе из указанных уравнений преобразуют подобно преобразованию исходного уравнения, вводя некоторую вторую постоянную величину. Такой процесс повторяют еще раз и получают четыре уравнения, каждое из которых содержит по одной переменной. Таким образом, приходится ввести всего три постоянные, называемые квантовыми числами и обозначаемые n, l и m.
Каждое из этих квантовых чисел может принимать множество различных значений, и каждой комбинации n, l и m соответствует одно из решений уравнения (2.3). Очевидно, что решений волнового уравнения может быть бесчисленное множество, но из него путем ряда ограничений отбирают только решения, обладающие физическим смыслом. Каждое решение волнового уравнения, учитывающее ограничения и отвечающее конкретной комбинации квантовых чисел n, l и m называется электронной орбиталью, которая определяет энергию электрона и его пространственное расположение в атоме.
Физический смысл волновой функции заключается в том, что ее квадрат (Ψ2) определяет вероятность нахождения электрона в той или иной точке пространства атома.
Если значения Ψ2 просуммировать по всем точкам пространства вокруг ядра, то полученный результат должен быть равен единице.
Рассмотрим далее, что представляют собой квантовые числа и как они связаны друг с другом:
1. Главное квантовое число ( n) может принимать целочисленные значения 1,2,3 и т.д. до ∞ и характеризует в основном энергетический уровень орбиталей или электронов в атоме. Оно связано со средним расстоянием электронов от ядра. Исторически энергетическим уровням (или оболочкам) были приписаны обозначения K, L, M , N, O, P, Q… Эти обозначения используются и в настоящее время параллельно с указанием значений главного квантового числа n. Так, К – оболочка или энергетический уровень, у которого n = 1; L - оболочка или энергетический уровень с n = 2 и далее M – (n = 3); N – (n = 4); O – (n = 5); P – (n = 6); Q – (n = 7). Каждому значению главного квантового числа n соответствует количество орбиталей, равное n2 .
2. Орбитальное квантовое число ( l ) называется также побочным или азимутальным квантовым числом. Оно определяет пространственную форму орбиталей (электронных облаков). Допустимые значения числа l ограничены значением главного квантового числа n, оно принимает целочисленные значения от 0 до (n - 1). Каждому значению l соответствуют электронные орбитали (электронные облака) особой формы.
При l = 0, независимо от значения n, электронные облака имеют сферическую форму. При l = 1 электронные облака принимают форму гантели, так что по обе стороны от ядра располагаются области высокой вероятности нахождения электронов, а при l = 2 форма электронных облаков напоминает четыре груши, обращенные черенками в сторону ядра (рис. 2.3.). При более высоких значениях l форма электронных облаков становится еще более сложной, но такие электронные облака не представляют большого интереса для химии. Состояния электронов со значением орбитального квантового числа l, равного 0, 1, 2, 3, 4, 5 принято обозначать строчными латинскими буквами, соответственно, s, p, d, f, g, h. Если каждому значению главного квантового числа соответствует определенный энергетический уровень орбиталей (оболочка), то каждому значению орбитального квантового числа соответствует совокупность орбиталей, образующих определенный подуровень (подоболочку). Иными словами, орбитали с одинаковыми квантовыми числами n и l называются подуровнями или подоболочками.
3. Магнитное (или ориентационное) квантовое число ( m) характеризует разрешенные ориентации орбиталей (или электронных облаков) в пространстве.
Очевидно, что число разрешенных ориентаций непосредственно связано с формой электронного облака, характеризуемой значением орбитального квантового числа l. Поэтому магнитное квантовое число m может принимать значения от – l до + l. Действительно, при l = 0 (s-подуровень) может быть только одна ориентация электронного облака, поскольку оно имеет сферическую форму (рис. 2.3), и m имеет только одно значение m = 0. При l = 1 (p-подуровень) возможны три разрешенные ориентации облака, соответствующие m = -1, 0, +1, (рис. 2.3) p(x), p(y), p(z). Аналогично у d- орбиталей m имеет пять значений: -2, -1, 0, +1, +2.



 z z z z
z z z z
 |  |  |  | ||||





 x x x x
x x x x
y y y y
s p(x) p(y) p(z)


 z z z
z z z
 |




 | |||||
 | |||||
 | |||||




 x x x
x x x
y y y
d(x2 –y2) d(z2) d(zx 
 )
)
z z
 | |||
 | |||




 x x
x x
y y
d(yz) d(xy)
Рис. 2.3. Форма s-, p-, d- орбиталей
Каждому набору трех квантовых чисел n, l и m соответствует одна орбиталь. Следовательно, орбиталей в атоме будет столько, сколько можно составить комбинаций из трех квантовых чисел так, чтобы эти комбинации отличались друг от друга хотя бы одним значением любого квантового числа. В таблице 2.1 показаны возможные комбинации квантовых чисел, количество которых равно числу орбиталей на уровнях и подуровнях. По данным таблицы видно, что обозначение каждого подуровня начинается с указания главного квантового числа соответствующего уровня, далее указывается орбитальное квантовое число, например: 1s, 2s, 3p и т.д.
Таблица 2.1
Допустимые значения квантовых чисел и количество
Орбиталей в атомах
|
Оболочка или уровень |
n |
l |
Обозначение подуровня (n l) |
M | Количество орбиталей | |
| на подуровне (2l+1) | на уровне n2 | |||||
| K | 1 | 0 (s) | 1s | 0 | 1 | 1 |
| L | 2 | 0 (s) 1 (p) | 2s 2p | 0 -1, 0, +1 | 1 3 | 4 |
| M | 3 | 0 (s) 1 (p) 2 (d) | 3s 3p 3d | 0 -1, 0, +1 -2,-1,0,+1,+2 | 1 3 5 | 9 |
| N | 4 | 0 (s) 1 (p) 2 (d) 3 (f) | 4s 4p 4d 4f | 0 -1, 0, +1 -2, -1, 0, +1, +2 -3, -2, -1, 0, +1, +2, +3 | 1 3 5 7 | 16 |
Каждый подуровень s содержит одну орбиталь, каждый подуровень p – по три орбитали, подуровень d – по пять орбиталей, подуровень f – по семь орбиталей. Все орбитали, относящиеся к одному подуровню, в изолированном атоме при обычных условиях обладают одинаковой энергией. Например, электроны в p(x)-, p(y)-, p(z) – орбиталях имеют одинаковое значение энергии и отличаются только пространственной ориентацией.
Существует способ изображения орбиталей в виде квадратных ячеек. Так как в многоэлектронных атомах электроны взаимодействуют как с ядром, так и друг с другом, то вследствие этого энергия (Е) орбиталей одного и того же уровня, но разных подуровней, различна.
Для объяснения некоторых экспериментальных данных были вынуждены ввести четвертое квантовое число, необходимость введения которого, однако, не вытекает из уравнения Шредингера. Это квантовое число характеризует сам электрон. Оказалось, что электрон обладает таким свойством, как будто он совершает веретенообразное вращение вокруг собственной оси и поэтому действует подобно крошечному магниту. Это четвертое квантовое число назвали спиновым квантовым числом и стали обозначать буквой s. Оно принимает значения +1/ 2 или -1/ 2 в зависимости от одной из двух возможных ориентаций магнитного момента электрона во внешнем магнитном поле.
Наличие электронного спина оказалось важным фактором, влияющим на строение атома. Это в 1925 г. первым осознал швейцарский физик В.Паули, сформулировав так называемый принцип запрета Паули: в атоме не может быть двух электронов, обладающих одинаковым набором всех четырех квантовых чисел n, l, m, s. В частности, он требует, чтобы в каждой орбитали находилось не более двух электронов с различными значениями s. Этот принцип позволяет понять одну из самых важных проблем химии - структуру Периодической системы элементов Д.И.Менделеева.
Кроме принципа Паули существует еще один принцип, в соответствии с которым электроны в атомах заполняют уровни и подуровни. Это принцип минимального значения энергии электронов. В соответствии с ним электроны, количество которых в атомах равно атомным номерам элементов, последовательно заполняют орбитали уровней и подуровней с энергией от низших значений к высшим (см. рис. 2.4). Размещение электронов в атомах выражают двумя способами: либо в виде электронных формул или электронных конфигураций, либо в виде орбитальных диаграмм. В электронных формулах, например, запись 2р3 обозначает, что на р-подуровне второго энергетического уровня находится три электрона.
В соответствии с принципом минимальной энергии выполняется правило Клечковского: с ростом атомного номера элементов электроны размещаются в атомах последовательно в орбиталях, характеризуемых возрастанием суммы главного и орбитального квантовых чисел ( n + l ); при одинаковых значениях этой суммы в случае различных n (уровней) электроны заполняют подуровни с меньшим значением n.
В таблице 2.2 показаны два способа выражения размещения электронов в атомах химических элементов Периодической системы Д.И.Менделеева: в виде электронных формул и в виде орбитальных диаграмм. На орбитальных диаграммах числа вверху - это магнитные квантовые числа орбиталей, буквы снизу - это обозначения соответствующих подуровней. В орбитальных диаграммах учтено, что энергия подуровней возрастает снизу вверх так же, как показано на рис. 2.4.
Атомом гелия завершается заполнение электронами уровня с главным квантовым числом n = 1, т.е. К-уровня. Все атомы, имеющие полностью заполненные электронами уровни, обладают очень устойчивой электронной конфигурацией, и это находит отражение в их химической инертности. Гелий - химически инертный элемент, им завершается также первый период таблицы Менделеева.
Таблица 2.2
|
из
5.00
|
Обсуждение в статье: Строение атома. Зависимость свойств элементов от строения их электронных оболочек. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

