 |
Главная |
Распределение электронов в атомах
|
из
5.00
|
по квантовым уровням
| Элемент | Число электронов | Орбитальная диаграмма | Электронная формула |
| Н | 1 | 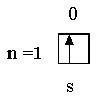
| 1s1 |
| Не | 2 | 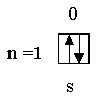
| 1s2 |
| Li | 3 | 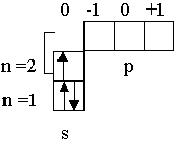
| 1s22s1 |
| Be | 4 | 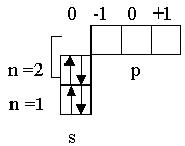
| 1s22s2 |
| B | 5 | 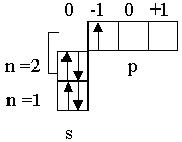
| 1s22s22p1 |
| C | 6 |              0 -1 0 +1
n=2
n=1 p
s 0 -1 0 +1
n=2
n=1 p
s
| 1s22s22p2 |
На втором уровне в соответствии с таблицей 2.1 имеются два подуровня ( s и р ) и четыре орбитали ( n2 ). Третий электрон атома лития заполнил во втором уровне s-орбиталь, имеющую энергию более низкую по сравнению с р-орбиталями. Спин этого электрона может быть любым, нами условно его значение выбрано +1/ 2. В атоме бериллия завершается заполнение 2s – подуровня, и у атома бора пятый электрон размещается в одной из трех орбиталей р-подуровня, энергия которых по рис. 2.4 одинакова.
В атоме углерода второй электрон р-подуровня не располагается в виде спаренного с первым электроном в одной орбитали, а размещается во второй орбитали и имеет такой же спин (+1/ 2), как и спин первого электрона этого подуровня. Такое размещение рассмотренного электрона осуществлено в соответствии с правилом Гунда: на данном подуровне электроны располагаются так, чтобы абсолютная сумма их спиновых квантовых чисел была максимальной, в связи с чем они занимают наибольшее число свободных орбиталей, имея одинаковое квантовое спиновое число ( s = +1/ 2 или s = -1/ 2 ). Очевидно, что сумма спиновых чисел электронной пары равна нулю.
| N | 7 | 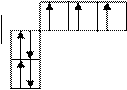 0 -1 0 +1 0 -1 0 +1
 n = 2
p
n = 1
s n = 2
p
n = 1
s
| 1s22s2 2p3 |
                O
O
| 8 | 0 -1 0 +1 n = 2 p n = 1 s | 1s22s2 2p4 |
                 F
F
| 9 | 0 -1 0 +1 n = 2 p n = 1 s | 1s22s2 2p5 |
 Ne
Ne
| 10 | 0 -1 0 +1
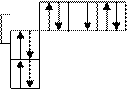 n = 2
p
n = 1
s n = 2
p
n = 1
s
| 1s22s2 2p6 |
Неон - последний элемент второго периода, в его атоме заполнены все орбитали с главным квантовым числом, равным двум (L - уровень). И это приводит к очень устойчивой электронной конфигурации. В результате неон является весьма инертным химическим элементом. Установлено также, что наличие октета (восьми) электронов во внешней оболочке атома или иона соответствует их особенно устойчивому электронному распределению (правило октета).
Третий период начинается с натрия и заканчивается аргоном. В нем происходит заполнение электронами s- и р- орбиталей третьего уровня ( М-уровня ), и остаются незаполненными пять d- орбиталей.
| Na | 11 |
-2 -1 0 +1 +2 
n=3 -1 0 +1 0 d
n=2
n=1 s | 
| ||||||||||||||||||||||||||||||||||||||||||
Первые два уровня в атомах элементов третьего периода заполнены полностью, как в атоме неона. Поэтому иногда в электронных формулах указанных атомов первые уровни записывают сокращенно в виде атома неона в квадратных скобках. У атома аргона внешний уровень электронов оказался аналогичным внешнему уровню атома неона, т.е. на нем восемь электронов. Поэтому по правилу октета атомы аргона очень устойчивы и химически инертны.
| Ar | 18 | [Ne]3s23p6 |
Следующий элемент калий попадает в четвертый период, так как у него в соответствии с принципом минимальной энергии и правилом Клечковского ( 4 + 0 < 3 + 2 ) девятнадцатый электрон занимает 4s- орбиталь при наличии свободных пяти 3d-орбиталей. Двадцатый электрон кальция также размещается на 4s-подуровне. Далее в атомах десяти последующих элементов от скандия до цинка включительно в соответствии с принципом минимальной энергии и правилом Клечковского происходит заполнение пяти 3d-орбиталей.
В пятом периоде по аналогии с четвертым периодом вначале в атомах рубидия (Rb) и стронция (Sr) заполняется 5s-подуровень, а затем от иттрия (Y) до кадмия (Сd) следуют десять переходных элементов, в атомах которых заполняется 4d- подуровень при наличии на 5s-подуровне от нуля ( у Pd) до одного ( у Ag, Ru, Rh, Nb, Mo) и двух ( у Y, Zr, Tc, Cd) электронов. Затем с индия (In) начинается заполнение 5p-подуровня, которое заканчивается октетом электронов на внешнем уровне в атоме ксенона (Хе), вследствие чего Хе – инертный элемент. В атоме ксенона остаются свободными семь 4f-, пять 5d-, семь 5f, и девять 5g-орбиталей.
В шестом и седьмом периодах картина повторяется. В атомах лантана (La) и актиния (Ас) начинается заполнение соответственно 5d- и 6d-подуровней с прерыванием заполнения этих подуровней в группах лантаноидов и актиноидов, в которых заполняются соответственно 4f- и 5f-подуровни. В шестом периоде заполнение 6р-подуровня заканчивается радоном (Rn) – инертным элементом. Седьмой период оказывается незаконченным.
Если сравнить электронные формулы атомов элементов одних и тех же подгрупп короткопериодной таблицы Менделеева, то окажется, что у них одинаковая электронная конфигурация внешних уровней. Эти элементы называют элементами-аналогами за сходство их химических свойств, а так как у их атомов на внешних уровнях одинаковое число электронов на одноименных орбиталях при разных значениях главного квантового числа, то их называют также электронными аналогами. Поэтому физический смысл периодического закона заключается в периодическом изменении свойств элементов в результате периодически повторяющихся сходных внешних электронных оболочек атомов при последовательном возрастании главного квантового числа.
Например, элементы главной подгруппы первой группы объединяют в одно семейство, которое называют щелочными металлами.
В Периодической системе элементов Д.И. Менделеева по рассмотренным признакам выделяют еще несколько семейств. Элементы главной подгруппы второй группы (подгруппа кальция: кальций, стронций, барий) образуют семейство щелочноземельных металлов с электронной конфигурацией внешнего уровня ns2. Элементы главной подгруппы седьмой группы образуют семейство галогенов, атомы которых имеют одинаковое строение внешних подуровней, заполненных электронами – ns2np5. Семейство инертных или благородных газов включает элементы главной подгруппы восьмой группы с октетной (кроме гелия) внешней электронной оболочкой ns2np6 (при n>1).
Следует отметить наличие еще трех семейств химических элементов, которые образованны не по сходству электронных конфигураций внешних уровней их атомов, а по более общим физическим и химическим свойствам элементов. Все элементы таблицы Менделеева делятся на металлы и неметаллы диагональю из девяти элементов: B, C, Si, Ge, As, Sb, Te, Po, At. Эти элементы обладают промежуточными свойствами между свойствами металлов и свойствами неметаллов и образуют семейство металлоидов. Элементы находящиеся слева от рассмотренной диагонали, составляют семейство металлов, в которое входят также переходные элементы. Элементы, находящиеся справа от диагонали, включая элементы самой диагонали (всего 24 элемента), составляют семейство неметаллов.
Элементы групп разделены на главные подгруппы, включающие элементы больших и малых периодов, и побочные подгруппы, состоящие из элементов только больших периодов. Главные подгруппы обозначают иногда буквой «А» (например элементы группы 7А: F, Cl, Br, I, At), побочные подгруппы обозначают буквой «Б» (например элементы группы 7Б: Mn, Tc, Re). Как уже отмечалось, в подгруппах находятся электронные аналоги. У атомов одних элементов сильнее выражена способность к потере электронов, для этого атомам надо сообщить некоторое количество энергии. Способность атомов к отдаче электронов называется восстановительными свойствами, а атомы, соответственно, восстановителями.
У атомов других элементов сильнее выражена способность к присоединению электронов, что сопровождается выделением энергии. Способность атомов к присоединению электронов называется окислительными свойствами, а атомы, соответственно окислителями. Сочетание восстановительных и окислительных свойств нейтральных атомов определяет химические свойства элементов.
Количественной характеристикой восстановительных способностей атомов является значение энергии ионизации, необходимой для отрыва одного электрона от нейтрального, невозбужденного атома. Это первая энергия ионизации Е1. Вторая энергия ионизации Е2 больше первой и идет на отрыв второго электрона от положительно заряженного иона. На отрыв следующих электронов идет все больше и больше энергии. Для многоэлектронных атомов, в принципе, существует столько значений энергии ионизации, сколько электронов в атомах.
Э(г) ® Э+(г)+е-, (2.4)
Э+(г) ® Э2+(г)+е- и так далее,
где Э - нейтральный атом, находящийся в газовой (г) фазе (т. е. изолированный от других атомов), Э+ и Э2+ - положительно заряженные ионы (катионы), также находящиеся в газовой фазе. Энергию ионизации этих процессов можно определить экспериментально или вычислить по закону Кулона:
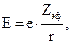 (2.5)
(2.5)
где е – заряд электрона, Zэф – эффективный заряд ядра, r – расстояние от ядра до отрываемого электрона.
При переходе слева направо вдоль каждого периода радиус атомов постепенно уменьшается.
У элементов, относящихся к одной подгруппе Периодической системы, радиус атомов последовательно увеличивается по мере возрастания порядкового номера (рис 2.7).
Первая энергия ионизации атомов Е1 имеет периодический характер зависимости от Z. В целом, в таблице Менделеева энергия ионизации элементов изменяется так, как показано на рис. 2.7.
Количественной величиной окислительных способностей атомов является значение энергии сродства к электрону, т. е., изменение энергии, происходящее при присоединении электрона к газообразному (изолированному) атому или иону. Для нейтрального атома этот процесс можно представить уравнением:
Э(г)+е- ® Э(г)-, (2.8)
а для иона с зарядом 1+ уравнением
Э+(г)+e- ®Э(г). (2.9)
Для большинства нейтральных атомов и всех положительно заряженных ионов присоединение электрона сопровождается выделением энергии, и поэтому энергия сродства к электрону Е' имеет отрицательную величину. Уравнение (2.9) описывает процесс, обратный ионизации нейтрального атома (2.4). Таким образом, сродство к электрону тесно связанно с энергией ионизации; энергия сродства к электрону для однозарядного положительного иона противоположна по знаку, но совпадает по абсолютной величине с энергией ионизации соответствующего нейтрального атома (Е1= - Е'1).
В целом при перемещении слева направо вдоль одного периода энергия сродства к электрону принимает все более отрицательные значения, что соответствует увеличению способности атомов притягивать электроны (росту окислительных свойств). Самые большие отрицательные значения энергии сродства к электрону характерны для галогенов, элементов группы 7А. Галогены имеют конфигурацию внешнего энергетического уровня ns2 np5 . Добавление всего одного электрона приводит к образованию устойчивой конфигурации внешнего уровня, характерного для атомов благородных газов.
Можно отметить, что восстановительная способность (отдача электронов) свойственна всем химическим элементам за исключением гелия ( He), неона ( Ne) и фтора (F), но изменяется для различных элементов в широких пределах. Окислительная способность – присоединение электронов отсутствует у элементов главных подгрупп 1-ой, 2-ой, 3-й и 8-ой групп и всех побочных подгрупп Периодической системы элементов. В результате ионизации атомы некоторых элементов превращаются в положительно заряженные ионы (катионы). Атомы других элементов в большей степени стремятся приобрести электроны, превращаясь при этом в отрицательно заряженные ионы (анионы). Катионы и анионы притягиваются друг к другу как противоположно заряженные частицы, образуя ионные кристаллы, например, NaCl.
Однако, чаще всего в молекулах или кристаллах электроны не переходят полностью от одних атомов к другим, а только смещаются. Это приводит к тому, что в таких случаях атомы одних элементов оказываются по отношению к атомам других элементов или болееэлектроположительными, или более электроотрицательными. Для сравнения таких способностей атомов введена особая характеристика, названная электроотрицательностью, которая определяется как относительная способность атомов в молекулах или кристаллах притягивать электроны. Она не является строго определенной физической величиной; это лишь относительная характеристика элементов. Электроотрицательность (ЭО) каждого элемента может быть определена только в сопоставлении с электроотрицательностью других элементов. Наибольшее распространение получила шкала относительной электроотрицательности (ОЭО), предложенная американским химиком Л. Полингом, основанная на учете энергии разрыва химических связей в молекулах и кристаллах. Максимальное значение ОЭО у фтора (4), минимальное у франция (0,7). В периодах ОЭО растет от щелочных металлов к галогенам, а в группах – уменьшается сверху вниз. Водород, который, строго говоря, не принадлежит ни к одной из групп, имеет такую же электроотрицательность, как бор.
В заключение подчеркнем, что немногие законы естествознания обладают такой же широкой применимостью как периодический закон в химии. В общем виде периодическое изменение величин, рассмотренных в денном параграфе свойств, представлено на рис.2.7, где стрелки показывают рост этих величин вдоль периодов и групп Периодической системы элементов.
E1, Zэф, ОЭО
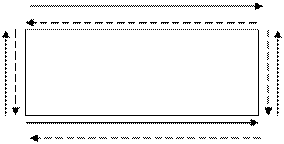
Таблица Менделеева
r
Рис.2.7. Изменения в таблице Менделеева величин атомного радиуса (r), первой энергии ионизации (Е1), эффективного заряда ядра (Zэф), электроотрица-тельости (ОЭО) атомов (стрелками показаны направления увеличения величин).
|
из
5.00
|
Обсуждение в статье: Распределение электронов в атомах |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы





 p
p