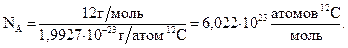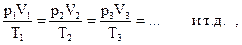|
Главная |
Основные законы и понятия химии. Химический эквивалент. Закон эквивалентов.
|
из
5.00
|
Лекция №1.
План лекции:
- Атомно-молекулярная теория
- Законы сохранения элементов, массы и энергии
- Периодический закон и периодическая система элементов
- Химический эквивалент и закон эквивалентов
- Газовые законы
Химия – одна из естественных наук, изучающая состав, структуру и процессы превращения веществ, а также тепловые эффекты и кинетику этих процессов.
В настоящее время известно более 110 различных сортов или типов атомов, 91 из них имеется на нашей планете, остальные получены искусственно. Чтобы как-то отличать эти типы атомов друг от друга, каждому из них дали название и символ, например, соответственно кислород O, или йод I. Каждый из них является определенным химическим элементом.
В основе химии лежит атомно-молекулярная теория. Ее основные постулаты заключаются в следующем:
1. Каждый химический элемент состоит из чрезвычайно мелких частиц, называемых атомами;
2. Все атомы одного элемента одинаковы;
3. Атомы различных элементов обладают разными свойствами (в том числе имеют разные массы);
4. Атомы одного элемента в результате химических реакций не превращаются в атомы других элементов; атомы не создаются и не разрушаются в химических реакциях;
5. Химические соединения образуются в результате комбинаций атомов двух или нескольких элементов;
6. В данном соединении относительные количества атомов различных сортов, а также сорта этих атомов всегда постоянны.
Например, шестой постулат включает в себя содержание закона постоянства состава, открытого французским химиком Ж.Л.Прустом в 1799 году: состав химических соединений остается постоянным независимо от способа их получения.
Четвертый постулат Д.Дальтона включает в себя содержание двух известных в то время законов: закона сохранения массы, открытого и экспериментально подтвержденного М.В.Ломоносовым в 1756г., и закона сохранения химических элементов, открытого французским химиком А.Л.Лавуазье в 1774г. Идею сохранения энергии в химических реакциях экспериментально доказал в 1848г. немецкий ученый Роберт Майер, которого и считают первооткрывателем этого закона.
Д.И.Менделеев расположил химические элементы в порядке возрастания их относительных атомных масс и обнаружил в этом ряду периодическую повторяемость физических и химических свойств элементов. На основании этого он сформулировал периодический закон: свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от величин атомных весов элементов. При этом весь ряд элементов оказался разбитым на отрезки, внутри которых начинается и заканчивается периодическое изменение свойств. Эти отрезки были названы периодами. Далее, поместив периоды друг под другом так, чтобы элементы со сходными свойствами оказались в общих вертикальных колонках, Д.И.Менделеев создал первую Периодическую систему элементов. Вертикальные колонки со сходными по свойствам элементами были названы группами.
В настоящее время в разнообразных таблицах Периодической системы элементов Д.И.Менделеева представлены некоторые характеристики химических элементов – это порядковый номер элемента, его название, символ и масса атома. Масса атомов (m0) выражена по углеродной шкале атомных масс в атомных единицах массы (а.е.м.), составляющих 1/12 массы изотопа углерода 12С, т.е. в относительных единицах массы. Чаще всего атомы одного и того же элемента, обладая совершенно одинаковыми химическими свойствами, могут иметь различную массу. Они называются изотопами. Так, углерод состоит из двух устойчивых изотопов 12С и 13С (верхние левые индексы – это масса атомов в а.е.м.), содержание которых в природе соответственно 99% и 1%.
В Периодической системе элементов массы атомов даны с учетом изотопных составов элементов. Например:
m0(C) = 12 а.е.м .× 0,99 + 13 а.е.м. × 0,01 = 12,011 а.е.м. или
m0(C) = 12,011 (без указания размерности массы). (1.1)
Молекулярная масса – это масса молекулы, выражения в атомных единицах массы.
m0(H2O) = 2m0(H) + m0(O) = 2×1,00794 + 15,999 = 18,01488, (1.2)
В химии практически важной единицей количества вещества является моль. В одном моле содержится столько же структурных единиц (атомов, молекул, ионов, электронов и т.д., т.е. частиц, из которых состоит вещество) сколько атомов в 12 г изотопа углерода 12С. Это число равно 6,022×1023 частиц/моль, обозначается NA и называется постоянной Авогадро. Так как массу атома 12С в настоящее время определили экспериментально при помощи прибора, называемого масс-спектрометром, (m0(12C) = 1,9927×10-23г), то NA можно вычислить следующим образом:
|
(1.3)
Масса одного моля частиц какого-либо вещества, выраженная в граммах, называется его молярной (или мольной) массой, обозначается латинской прописной буквой M и имеет размерность г/моль. Молярная масса вещества в граммах численно равна его молекулярной или атомной массе, выраженной в атомных единицах массы: M = m0 г/моль. Для примера (1.2) можно написать следующие значения M:
M (H2O) = 18,01488 г/моль. (1.4)
Эквивалент вещества (Э) – это его частица или доля частицы, которая соответствует иону водорода, замещает его или реагирует с ним в ионно-обменных реакциях, а в окислительно-восстановительных реакциях взаимодействует с одним электроном.Как атомы и молекулы эквивалентны обозначаются химическими символами и являются безразмерными частицами. Их состав определяется типом химической реакции, в которой они участвуют или природой химического соединения, в состав которого они входят. Например:
Ca (OH)2 + H2SO4 = Ca SO4 + 2H2O. (1.6)
Это реакция нейтрализации между кислотой и основанием с образованием воды и соли. В ней каждый протон серной кислоты соединяется с гидроксид–ионом основания, образуя молекулу воды. Так как в реакции участвуют два протона (протон – это ион водорода H+), то одному протону будут соответствовать следующие уравнение реакции и частицы:
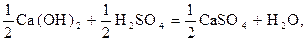
откуда
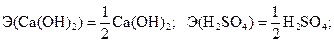
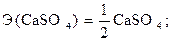
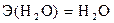 .
.
Реакция образования воды в результате сгорания водорода в кислороде является окислительно-восстановительной:
2H2 + O2 = 2H20, (1.7)
В ней участвует 4 электрона. На один электрон приходятся следующие уравнение и частицы:
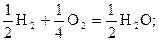
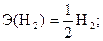
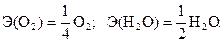
Таким образом, в реакции (1.6) эквивалент воды равен её молекуле, а в реакции (1.7) эквивалент воды составляет только половину молекулы.
Число Авогадро эквивалентов (частиц) составляет один моль эквивалентов, масса которого в г/моль называется молярной массой эквивалентов или эквивалентной массой (МЭ) вещества. Например: Мэ(H2O) = 18 г/моль в (1.6), Мэ(H2O) = 9 г/моль в (1.7). Если известны масса и эквивалентная масса вещества, то можно вычислить число молей эквивалентов (nэ) данного вещества: nэ = m/Mэ (аналогично n=m/M).
В случае веществ, имеющих постоянный химический состав, всегда выполняется закон эквивалентов: вещества вступают в реакции и входят в состав химических соединений в относительных количествах по массе, пропорциональных их эквивалентным массам:
m1/m2 = MЭ (1) / MЭ (2) , (1.8)
где mi и MЭ (i) - массы и эквивалентные массы веществ 1 и 2.
Из (1.8) вытекает (1.9), а именно, что в реакциях и химических соединениях числа молей различных эквивалентов одинаковы:
m1/MЭ (1) = m2 /MЭ (2) или nЭ (1) = nЭ (2) . (1.9)
Известны формулы для вычисления эквивалентных масс химических соединений (а) и элементарных веществ (б):
а) MЭ = M / zB,
где В – валентность функциональной группы; z – число функциональных групп: в кислотах – протонов, в основаниях – гидроксид-ионов, в оксидах – атомов элементов, в солях – катионов;
б) MЭ = M / В,
где В – валентность атома элемента.
Газы всех веществ существенно отличаются от жидкостей и твердых веществ по многим признакам. Например, газ расширяется, заполняя весь сосуд, тогда как объемы твердых веществ и жидкостей не определяются объемом сосуда. Характерным свойством газов является их большая сжимаемость. Если к газу приложить давление, то его объем заметно уменьшится. В отличие от газов твердые и жидкие вещества не обладают большой сжимаемостью. Два или несколько газов образуют однородные смеси в любых пропорциях независимо от природы этих газов. Например, жидкие вода и бензин не смешиваются и после механического перемешивания в сосуде расслаиваются. В этом случае их пары над поверхностью жидкости образуют однородную газовую смесь. Характерные свойства газов обусловлены тем, что отдельные молекулы газа находятся сравнительно далеко друг от друга. Так, если в жидких и твердых веществах молекулызанимают примерно 0,7 объема этих веществ, то в разреженных газах (при p ~ до 10 атм) молекулы занимают примерно 0,001 их объема, такие газы ведут себя как идеальный газ. Сравнительно высокая степень изоляции молекул является причиной сходства свойств разных газов, несмотря на то, что они состоят из разных молекул.
Эксперименты с большим числом газов, выполненные разными учеными, показали, что для определения состояния многих газообразных веществ достаточно знать такие параметры, как температура T, давление p, объем V и молярное количество n. Связь между этими параметрами выражается уравнением состояния идеального газа, которое выведено эмпирически французским ученым Б. Клапейроном и усовершенствовано Д.И. Менделеевым:
pV = nRT, (1.10)
где p – давление в паскалях ( Па = Н/м2) или атмосферах (атм.); V – объем в м3 или литрах (л); n – число молей газа; T – температура в кельвинах (К); R – газовая постоянная, равная 8,314 Дж/(моль·К) (система СИ) или 0,08206 л·атм/(моль·К).
В качестве простого примера применения уравнения состояния идеального газа вычислим объем 1 моля газа при 0 0С (273,15 К) и давлении 1атм. Эти значения температуры и давления в совокупности называются стандартными или нормальными условиями (н.у.) для газов. Преобразуем уравнение (1.10), выразив через него V, и поставим в него все необходимые численные значения:
| |
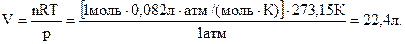 (1.11)
(1.11)
Согласно уравнению состояния идеального газа такой объем занимает 1 моль любого газа при нормальных условиях. Его называют молярным объемом и обозначают нижним индексом “м” − Vм:
Vм = 22,4 л/моль. (1.12)
Из соотношения молярной и эквивалентной масс можно вычислить эквивалентный объем газа при нормальных условиях M/MЭ = VМ/VЭ:
VЭ = VММЭ/М (л/моль). (1.13)
Так, эквивалентные объемы водорода и кислорода соответственно равны:
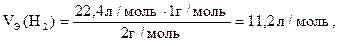
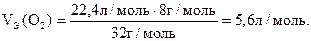 (1.14)
(1.14)
При фиксированных n и T произведение pV является постоянным:
pV = nRT = const (const – постоянная величина). (1.15)
Это соотношение можно преобразовать:
V = const/p. (1.16)
Уравнение (1.16) означает, что при постоянной температуре объем данного количества газа обратно пропорционален его давлению. Оно было установлено экспериментально в 1662 году английским ученым Р.Бойлем и носит название закона Бойля.
Как следует из уравнения (1.10), увеличение количества газа при постоянной температуре приводит к возрастанию произведения pV. Если это изменение происходит при постоянном объеме, то возрастать будет только давление, для которого можно записать:
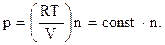 (1.17)
(1.17)
Так как реальные газы при низких давлениях подчиняются уравнению (1.10) независимо от химической природы частиц, то можно для смеси газов вместо (1.17) написать:
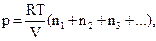 (1.18)
(1.18)
где 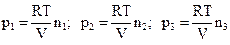 и т.д. являются значениями давления, которое оказывает каждый газ в отдельности, занимая одинаковый объем при одинаковой температуре. Эти давления называются парциальными давлениями компонентов газовой смеси. Закон парциальных давлений экспериментально установленный в 1801 году Д.Дальтоном гласит: в смеси газов каждый газ оказывает такое давление (парциальное), какое оказывал бы он при отсутствии других газов, занимая весь объем смеси при той же температуре, а общее давление смеси равно сумме парциальных давлений ее компонентов:
и т.д. являются значениями давления, которое оказывает каждый газ в отдельности, занимая одинаковый объем при одинаковой температуре. Эти давления называются парциальными давлениями компонентов газовой смеси. Закон парциальных давлений экспериментально установленный в 1801 году Д.Дальтоном гласит: в смеси газов каждый газ оказывает такое давление (парциальное), какое оказывал бы он при отсутствии других газов, занимая весь объем смеси при той же температуре, а общее давление смеси равно сумме парциальных давлений ее компонентов:
p = p1+ p2 + p3 + … . (1.19)
В 1811 году итальянский ученый Амедео Авогадро выдвинул гипотезу о том, что в равных объемах различных газов, находящихся при одинаковых условиях, содержится одинаковое число молекул. Примерно через пятьдесят лет гипотеза была доказана и стала законом. Действительно, по уравнению (1.10) для равных объемов газов (V=const) при одинаковых условиях (p = const и T = const) получим одинаковое число молей (n = const):
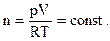 (1.20)
(1.20)
А так как n = N/NA, то N = const (N – число молекул). В частности, в молярных объемах (VM = 22,4 л/моль) различных газов при нормальных условиях содержится число молекул, равное числу Авогадро (NA).
В начале 19 века гипотеза Авогадро позволяла достаточно точно определять относительные молярные массы газообразных веществ. Рассмотрим в качестве примера два равных объема различных газов при одинаковых условиях (V1=V2). Пусть массы этих газов в граммах будут равны соответственно m1 и m2. Тогда, выразив массы газов произведением числа их частиц на массу одной молекулы (M/NA) получим:
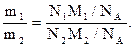 (1.21)
(1.21)
Так как по гипотезе Авогадро N1=N2, то вместо (1.21) будет:
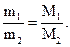 (1.22)
(1.22)
Таким образом, если молярная масса одного газа известна, например M2, то достаточно взвесить газы, чтобы определить M1 по (1.22):
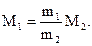 (1.23)
(1.23)
В уравнениях (1.22) и (1.23) соотношение масс можно заменить соотношением плотностей газов, так как V1=V2:
|
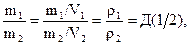 (1.24)
(1.24)
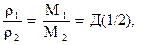 (1.25)
(1.25)
где ρ - плотность газа, Д (1/2) – относительная плотность первого газа по второму. В частности, при нормальных условиях для любого газа 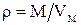 .
.
В заключение отметим, что если все параметры данного количества газа изменяются, то по уравнению (1.10) выполняется следующее соотношение:
|
так как (pV/T)=nR (nR в данном случае const).
Лекция №2.
|
из
5.00
|
Обсуждение в статье: Основные законы и понятия химии. Химический эквивалент. Закон эквивалентов. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы