 |
Главная |
Растворы (продолжение).
|
из
5.00
|
План лекции:
1. Произведение растворимости.
2. Законы Рауля.
3. Осмос.
Рассмотрим равновесия, возникающие при растворении или осаждении мало растворимых твердых веществ. Такие реакции являются гетерогенными. Для того чтобы между твердыми веществом и его раствором установилось равновесие, раствор должен быть насыщенным и находится в соприкосновении с нерастворившейся частью твердого вещества. Например:
растворилось L образовалось L образовалось L
BaSO4 (тв) « Ba2+ (водн) + SO  (водн)
(водн)

Сульфат бария – ионное соединение – сильный электролит. Такие вещества присутствуют в растворе в виде ионов. Константа равновесия для (60) имеет следующее выражение:
 ,
,
в нем концентрация твердого сульфата бария является постоянной величиной, которую можно перенести в левую часть равенства. Тогда получим новую константу, которая называется произведением растворимости и обозначается либо ПР, либо КL:
ПР(BaSO4) = C(Ba2+)C(SO  ) = L2
) = L2
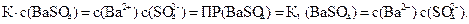
 , ПР – табличная величина.
, ПР – табличная величина.
Произведение растворимости равно произведению молярных концентраций ионов, участвующих в равновесии, каждая из которых возведена в степень, равную стехиометрическому коэффициенту при соответствующем ионе в уравнении равновесия.
Ca3(PO4)2 (тв.) « 3 Ca2+ (водн) + 2 PO  (водн)
(водн)
ПР =  ; ПР=(3L)3(2L)2=108L5
; ПР=(3L)3(2L)2=108L5

KClO4 (тв) « K+ (водн) + ClO  (водн)
(водн)
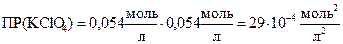
Одноименные ионы понижают растворимость, но ПР остается постоянной величиной при Т= const .
Пример: Вычислить растворимость KClO4 в растворе КСl с концентрацией 0,2 моль/л. Концентрации ионов в исходном растворе:
с(К+) = с(Сl-) = 0,2 моль/л.
Допустим, что растворится х моль/л KClO4, тогда
ПР(KClO4) = 29×10-4 = х×(0,2 + х)
х = с(СlO 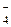 ) х2 + 0,2 х - 29×10-4 = 0
) х2 + 0,2 х - 29×10-4 = 0
(х + 0,2) = с(К+) х = 0,014
Видно, что растворимость перхлората калия (L(KClO4) моль/л) в растворе KCl (с = 0,2 моль/л) уменьшилась в 4 раза.
Значения ПР различных веществ даны в таблицах.
Пример: Если слить вместе растворы растворимых солей BaCl2 и Na2SO4, то осадок BaSO4 выпадет и равновесие установится только при условие, что произведение ионных концентраций Q = c ( Ba 2+ ) c ( SO  ) окажется больше, чем КL(ВаSO4).
) окажется больше, чем КL(ВаSO4).
Между ионным произведением Q и истинным ПР возможны следующие соотношения:
1) при Q > ПР, осаждение продолжается до тех пор, пока Q не станет равным ПР;
2) при Q=ПР, положение равновесия достигнуто (насыщенный раствор);
3) при Q < ПР, твердые вещества растворяются, до Q=ПР.
Растворимость любой соли, анион которой обладает основными свойствами, в какой-то степени зависит от рН. Например, растворение Mg(OH)2 описывается равновесием:
Mg(OH)2 (тв.) « Mg2+ + 2 OH-;
ПР =1,8×10-11, L = 1,65×10-4 (моль/л)
Если растворение Mg(OH)2 проводить в буферном растворе, рН которого 9, то рОН будет 5, а концентрация ОН- будет равна 10-5 (с(ОН-)=10-5)
ПР = с(Mg2+) c2(OH-) = 1,8×10-11, откуда
L(Mg(OH)2) = c(Mg2+) = 1,8×10-11/10-10 = 0,18 (моль/л)
Видно, что в буферном растворе с рН=9 растворимость Mg(OH)2 возрасла на три порядка. Если бы раствор был кислым, то растворимость Mg(OH)2 была бы еще выше за счет связывания OH- - ионов протонами в молекулы воды.
Значительное изменение кислотности или основности раствора оказывает влияние на растворимость почти всех солей. В большей степени это влияние заметно в тех случаях когда один или оба иона соли обладают достаточно сильными кислотными или основными свойствами.
Законы Рауля отражают коллигативные свойства растворов, то есть такие, которые зависят только от концентрации частиц растворенного вещества, а не от его состава. Законы Рауля применимы для разбавленных растворов нелетучих веществ.
Рассмотрим две системы:
1. Чистый растворитель и находящийся с ним в равновесии насыщенный пар растворителя, давление которого обозначим P0;
2. Раствор неэлектролита и находящийся с ним в равновесии насыщенный пар растворителя, давление которого обозначим P.
Давление насыщенного пара растворителя над раствором всегда меньше давления насыщенного пара растворителя над чистым растворителем, т.к. при растворении вещества концентрация частиц растворителя в растворе уменьшается и динамическое равновесие между раствором и насыщенным паром растворителя смещается в сторону раствора.
Согласно первому закону Рауля давление насыщенного пара растворителя над раствором пропорционально мольной доле растворенного вещества:
P=P0х0; x0=n0/(n0+n1)
где P-давление насыщенного пара растворителя над раствором,
P0-давление насыщенного пара над чистым растворителем
х0-мольная доля растворенного вещества в растворе
n1-количество растворенного компонента
Учитывая, что х1=1-х, получим
(P0-P)/р0=х1, где х1= n1/(n0+n1)- мольная доля растворенного компонента.
По второму закону Рауля повышение температуры кипения раствора  и понижение температуры замерзания (кристаллизация)
и понижение температуры замерзания (кристаллизация)  пропорционально моляльной концентрации растворенного вещества.
пропорционально моляльной концентрации растворенного вещества.

где  - моляльная концентрация растворенного вещества в моль/кг,
- моляльная концентрация растворенного вещества в моль/кг,  -количество растворенного вещества в моль ,
-количество растворенного вещества в моль ,  -масса растворителя в кг,
-масса растворителя в кг,  и
и  -эбулиоскопическая и криоскопическая постоянная, характеризующие природу растворителя.
-эбулиоскопическая и криоскопическая постоянная, характеризующие природу растворителя.
Осмотическое давление.
Осмосом называется самопроизвольный переход молекул растворителя через полупроницаемую мембрану, разделяющую растворитель и раствор или два раствора с разной концентрацией. При этом молекулы растворителя переходят из менее концентрированного раствора в более концентрированный. Давление, которое необходимо создать для предотвращения осмоса, называется осмотическим. Вант-Гофф, примерив для расчета осмотического давления уравнение состояния идеального газа, выел формулу расчета осмотического давление
πV=nRT
π=n/V RT
π=c1RT
где π-осмотическое давление в Па,М – объем раствора в м3, n1 – количество растворенного вещества в моль, Т – температура в К, R-универсальная газовая постоянная, c1 – молярная концентрация в моль/ м3
Осмос играет важную роль в биологических процессах, т.к. стенки клеток являются полупроницаемыми мембранами, пропускающими молекулы растворенных в ней веществ.
Законы Рауля и осмос в растворах электролитов.
Рассчитать по законам Рауля температуры кипения и замерзания и вычисленное по уравнению состояния идеального газа соответствуют экспериментально определенным только для разбавленных растворов неэлектролитов. В растворах электролитов вычисленные величины значительно отличались от определенных экспериментально
. Поэтому Вант-Гофф ввел поправочный коэффициент i, названный изотоническим. Он учитывает увеличение количества частиц растворенного вещества в растворе электролита за счет процесса диссоциации. Его величина зависит от степени диссоциации  и количества ионов образующихся при распаде молекулы
и количества ионов образующихся при распаде молекулы 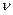 и может быть рассчитан по формуле
и может быть рассчитан по формуле
i=1+  (
( 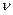 -1)
-1)
Подставляя изотонический коэффициент в уравнение расчета осмотического давления и законы Рауля, получаем:
(P0-P)/P0=ix1

Лекция №7.
Аналитическая химия
План лекции:
1. Задачи аналитической химии.
2. Методы качественного химического анализа.
3. Методы количественного химического анализа.
4. Основные методы физико-химического анализа.
Основной задачей аналитической химии является определение состава веществ. При этом решаются две задачи: 1) устанавливается природа компонентов, из которых состоит исследуемое вещество (это качественный анализ); 2) устанавливаются количественные соотношения найденных компонентов в исследуемом веществе (это количественный анализ).
Методы качественного химического анализа основаны на применении так называемых аналитических реакций (качественных химических реакций). К их числу относятся любые химические превращения, в результате которых образуются вещества, обладающие каким-либо характерным свойством. По наблюдаемым эффектам аналитические реакции можно разделить на четыре группы:
1) реакции с образованием характерных осадков,
2) реакции, сопровождающиеся растворением осадков,
3) реакции, сопровождающиеся появлением или изменением окрасок растворов,
4) реакции, идущие с выделением газов.
В качестве примера можно привести следующие реакции:
а) кислотно-основные реакции;
для обнаружения ацетат-ионов к их раствору надо добавить сильной кислоты:
С2Н3О2- + Н+ ⇄ НС2Н3О2,
наблюдаемое свойство - запах уксусной кислоты.
б) реакции с образованием осадка;
В этих реакциях выпадают в осадок малорастворимые вещества. Например, в результате следующих ионообменных реакций образуются:
Ag+ + Cl- ⇄ AgCl(тв)
белый осадок хлорида серебра, растворимый в растворе аммиака.
в) реакции комплексообразования;
Например, осадок, полученный в предыдущей реакции растворяется вследствие образования комплексного соединения:
АgСl(тв) + 2NH3 ⇄ [Ag (NH3)2]+ + Сl-,
белый бесцветный раствор
г) реакции с выделением газа;
Н+ + НСО3- ⇄ Н2О + СО2(г) .
Для характеристики чувствительности качественных реакций используют понятия предельной концентрации и предела обнаружения. Предельная концентрация (ПК) - это минимальная концентрация вещества в растворе (выраженная обычно в г/мл), при которой оно может быть обнаружено. По аналогии с рН её часто выражают в логарифмической форме:
ПК (г/мл), pД = -lg ПK.
Очевидно, чем больше рД, тем чувствительнее реакция. Предел обнаружения представляет собой не концентрацию, а абсолютное количество вещества. Это минимальное количество вещества, которое можно обнаружить с помощью данной реакции в одной капле анализируемого раствора (т.е. в 0,05 мл). Например, при рД = 5 предел обнаружения будет следующим:
(10-5 г/мл)∙0,05мл = 0,5 ∙ 10-6г = 0,5 мкг.
Важную, роль в проведении качественных реакций играют проба сравнения и контрольная (холостая) проба. В качестве пробы сравнения используют раствор чистого вещества, которое необходимо обнаружить в анализируемом растворе. С раствором чистого вещества проводят такие же реакции, как и с исследуемым раствором, и результат сравнивают с результатом, полученным для анализируемого раствора. Холостую пробу проводят для того, чтобы убедиться в том, что используемые для анализа вещества - реактивы не загрязнены обнаруживаемым ионом. Её проводят с чистой водой.
Одной из важнейших характеристик аналитических реакций является их специфичность.Специфичными принято называть такие качественные реакции, которые в данных условиях дают положительный результат только для одного иона.
Предварительные испытания позволяют определить наличие некоторых ионов до проведения общего анализа веществ.
1) Например, по окрашиванию бесцветного пламени горелки можно ориентировочно установить наличие ряда элементов, как в твёрдом веществе, так и в растворе. Для этого каплю раствора или щепоточку вещества вносят при помощи платиновой или нихромовой проволочки в пламя горелки и по изменению его цвета судят о наличии в пробе того или иного элемента (табл.1).
Цвет пламени горелки в зависимости от природы элемента, содержащегося в пробе
| Элемент | Na | K | Ca | Sr | Ba | Cu, B, Bi | Pb, Sn, Sb, As |
| Цвет пламени | Жёлтый | Фиоле-товый | Кирпично-красный | Карминово-красный | Зеленовато-жёлтый | Зелёный | Бледно-синий |
2) Термическая обработка образца пробы в фарфоровой чашке, тигле, в стеклянной или кварцевой трубке для прокаливания с постепенным нагреванием до 600 °С (красное каление). При этом возможны: возгонка вещества или его компонентов, их термическое разложение или окислительно-восстановительные реакции.
а) Если вещество частично возгоняется и оседает на холодных участках трубки в виде белого сублимата-налёта, то тогда можно предположить, что в пробе либо соли аммония, либо хлориды или бромиды ртути, либо оксиды мышьяка или сурьмы. Если налёт серый с металлическим блеском, то в пробе либо соединения ртути или мышьяка и вещества-восстановители, либо иодиды и вещества-окислители. Жёлтый налёт указывает на наличие соединений ртути или серы (сульфидов, тиосульфатов). Образование на стенках трубки капель воды указывает на наличие в пробе кристаллогидратов либо гидроксидов, либо основных или кислых солей.
3) Действие на пробу кислот. Разбавленные НС1 и H2SO4 (2н) разлагают карбонаты с выделением СО2; сульфиты и тиосульфаты - с выделением SO2; сульфиды - с выделением сероводорода (H2S) , имеющего запах тухлых яиц; нитраты - с выделением NO2.
4) Растворимость пробы в воде.Если вещество растворяется, то в нём нет карбонатов тяжёлых металлов; сульфатов катионов второй группы; хлоридов катионов пятой группы; сульфидов катионов третьей, четвертой и пятой групп. По значению рН раствора можно предположить наличие или отсутствие в пробе солей, подвергающихся гидролизу.
Дробным анализом принято называть методы качественного определения ионов с помощью специфических реакций. В этом методе операции по определению каждого иона проводятся с отдельной порцией раствора. Последовательность определения ионов не имеет значения. Дробный анализ применяется в случае сравнительно простых по составу объектов, содержащих не более пяти ионов, состав которых ориентировочно известен.
В случае сложных по составу объектов, содержащих большое число ионов, применяют определенную систему последовательных операций по разделению ионов на группы и подгруппы. При этом используются групповые реагенты, которые образуют труднорастворимые вещества с группой близких по свойствам ионов. Внутри групп или подгрупп последовательно определяют каждый ион при помощи методов дробного анализа. Такой анализ называется систематическим
В качестве примера рассмотрим один из классических методов систематического анализа разделения катионов на группы, который принято называть сероводородным
|
из
5.00
|
Обсуждение в статье: Растворы (продолжение). |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

