 |
Главная |
Порядок выполнения работы.
|
из
5.00
|
5.1. Осаждение.
Условие образования осадка: произведение концентраций ионов в растворе, обра- зующих малорастворимое соединение должно превышать произведение растворимости.
5.1.1. Имеем растворы BaCl2 и Na2C2O4 равной концентрации (С=5×10-4моль/л). В пробирку наливаем 5 капель раствора BaCl2, затем добавляем 5 капель Na2C2O4. Будет ли образовываться осадок? Почему? Ответ пояснить расчетами ПР.
|
 |
Расчеты: ПР (BaC O ) = 1.7 ×10-7
|
|
|
 |
C( C(Ba 2+ ) × C(С O2- ) =
|
|
Вывод:
 |
5.1.2. Берем 5 капель раствора BaCl2 другой концентрации (С=0.05 моль/л), помеща- ем в пробирку, затем 5 капель раствора Na2C2O4 (С=0.05 моль/л). .Будет ли образовываться осадок? Почему? Ответ пояснить расчетами ПР.
|
 |
Расчеты: ПР (BaC O ) = 1.7 ×10-7
|
|
|
 |
C( C(Ba 2+ ) × C(С O2- ) =
|
|
Вывод:
 |
5.2. Влияние рН на осаждение гидроксидов.
Рассчитываем рН начала осаждения Fe(OH)3 из раствора FeCl3, концентрация которо- го 0.1 моль/л.
|
ПР Fe(OH)3
ПР Fe(OH )3
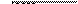 -
-
= 10-38 ,
= [Fe3+ ]× [OH - ]3 = 10-38 ,
[OH ]= =
pH = 14 - pOH , pOH = -lg[OH- ]= pH =
Подтвердим расчеты экспериментально.
В пробирку наливаем 5 капель раствора FeCl3 (С=0.1 моль/л), измеряем рН (рН<<1,
т.к. раствор подкислен для подавления гидролиза) и добавляем по каплям NH4ОН (конц.).
После того, как появляется осадок, не исчезающий при перемешивании, проверяем рН рас- твора: pH =
Рассчитываем рН конца осаждения, при этом концентрация ионов
Fe3+ = 10-6 моль/л,
так как осаждение считается полным, если концентрация ионов в растворе не превышает
10-6 моль/л.
 -
-
[OH ]= =
pH = 14 - pOH , pOH = -lg[OH- ]= pH =
Вывод:
Таким образом, экспериментально установлено рН начала осаждения Fe (ОН)3, кото-
 рое составляет
рое составляет
5.3. Дробное осаждение.
В растворе находится смесь солей K2SO4 и K2СrО4.
C 2- = C 2 - = 0.1 моль/л. К смеси добавляют раствор ацетата свинца Pb(CH3COO)2
SO4 CrO4
с концентрацией 0.1 моль/л.
Какой осадок выпадет в первую очередь? Какова полнота осаждения одного иона к моменту осаждения другого?
|
ПРPbCrO
= 1.6 ×10-8 ,
|
Наблюдаем:
 В первую очередь должен выпасть осадок РbСrО4, так как
В первую очередь должен выпасть осадок РbСrО4, так как
ПРPbCrO
|
твердим расчетами. Найдем наименьшие концентрации ионов Pb2+,необходимые для обра- зования осадков РbSO4 и РbСrО4.
Расчеты: PbSO 4 Û
|
[Pb
2+ ] 4
PbCrO 4 Û
|
[Pb
4
2+ =
Сопоставляем концентрации Pb2+ необходимые для выпадения осадка РbSO4 и РbCrO4 и делаем вывод
 |
Выясним, насколько полно будет осаждаться РbСrО4 к моменту начала осаждения
осадка РbSO4.
Расчеты:
В процессе осаждения РbCrO4 концентрация Рb2+ будет определяться соотношением

|
4
По мере осаждения СrО42- это отношение возрастает. Соответственно этому будет возрастать и концентрация Рb2+ в растворе. Когда она достигнет величины, необходимой
для образования осадка РbSO4, будут одновременно осаждаться РbСrО4 и РbSO4. Это про- изойдет тогда, когда будет выполняться равенство:
[Pb 2+ ]= ПРPbCrO4 = ПРPbSO4 .
 |  |
[CrO2- ] [SO2- ]
4 4
|
[CrO2- ]=
ПРPbCrO4
× [SO2- ]

|
4 ПР
PbSO4
Выво д: Следовательно, к началу осаждения ионов [SO2- ] ионы [CrO2- ] будут осаж-
4 4
дены (полностью/не полностью)
5.4. Растворение.
Для того, чтобы оценить растворение осадка с количественной стороны, т.е. ответить на вопросы: сколько вещества растворится, какой концентрации растворитель и какой объ- ем его необходимо взять, чтобы полностью растворить осадок и т. д., необходимо предста- вить процесс растворения в виде соответствующих реакций и провести расчет равновесия.
Оценим растворимость малорастворимого электролита ВаС2О4 в сильной и слабой кислотах.
Раствор с осадком BaC2O4, полученным в опыте 5.1.2, тщательно перемешиваем и разливаем поровну 5 капель в 1 и 2 пробирки.
1 пробирка: добавляем 10 капель раствора НСl концентрации 1 моль/л;
Наблюдения: осадок (растворяется/нерастворяется) .
2 пробирка: добавляем 10 капель раствора СН3СООН концентрации 1 моль/л. Наблюдения: осадок (растворяется/нерастворяется) . Чем объяснить различие в растворимости?
1) Вычислим растворимость ВаС2О4 в HCl (1 моль/л).
BaC O
Û Ba2+ + C O2-
K1 = ПРBaC O
2 4 2 4 2 4
C O2- + H+ Û HC O- 1
 |
2 4 2 4
K 2 = K

|
BaC O + H+ Û Ba 2+ + HC O-
K = K1 × K 2
2 4 2 4
С 1
1-x x x
|
K -
HC2O4
1.7 ×10-7 =
 5.1×10-6
5.1×10-6
x 2

1 - x
= K =
Находим x, решая квадратное уравнение.
x = моль/л.
Растворимость = x.
Выражаем растворимость ВаС2О4 в г/л. М(ВаС2О4) =
s = x × M(BaC2O 4 ) =
г/л.
Растворимость ВаС2О4 в НСl концентрации 1 моль/л составля- ет
2) Рассчитаем растворимость ВаС2О4 в уксусной кислоте СН3СООН (1моль/л).
BaC O
Û Ba2+ + C O2-
K1 = ПРBaC O
2 4 2 4 2 4
|
C O2- + H+ Û HC O-
K 2 = KCH COOH
|
 |
2 4 2 4
K 3 = K

|
BaC O + CH COOH Û Ba 2+ + HC O- + CH COO-
K = K1 × K 2 × K3
2 4 3 2 4 3
С 1
1-x x x x
ПРBaC O × KCH COOH
1.7 ×10-7 ×1.8 ×10-5
 K = 2 4 3 =
K = 2 4 3 =
K -
HC2O4
5.1×10-6 =

 x 3 1 - x x =
x 3 1 - x x =
= K =
=
x = моль/л.
Растворимость = x.
Выражаем растворимость ВаС2О4 в г/л. М(ВаС2О4) =
s = x × M(BaC2O 4 ) =
г/л.
Т.о. растворимость ВаС2О4 в уксусной кислоте концентрации 1 моль/л составляет
, что значительно (меньше/больше)
растворимости этого соединения в хлороводородной кислоте.
6. Контрольные вопросы.
6.1. Что называется растворимостью и в чем ее выражают?
6.2. Произведение растворимостей и правило произведения растворимостей?
6.3. Какие факторы влияют на образование осадка?
6.4. Какие факторы влияют на растворение малорастворимых соединений?
6.5. Применение ПР в аналитической практике.
Общий вывод:
 |
Дополнения и исправления
 |
Зачтено
Дата
|
из
5.00
|
Обсуждение в статье: Порядок выполнения работы. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

