 |
Главная |
Клинический пример применения Ботулотоксина типа А при нейрогенной дисфункции нижних мочевых путей
|
из
5.00
|
РНПЦ неврологии и нейрохирургии совместно с кафедрой урологии БГМУ и 4 городской клинической больницей им. Н.Е. Савченко на протяжении последних лет активно занимается изучением проблемы комплексной диагностики и лечения заболеваний нервной системы с учетом нарушения функции мочеиспускания. Итогом работы послужило создание функционального нейроурологического центра.
Освоение и внедрение в практику методики лечения НДНМП с помощью инъекций препарата БТ-А «ДИСПОРТ» в 2009 году позволило нам расширить возможности оказания помощи неврологическим больным с нарушением функции мочеиспускания. На базе РНПЦ неврологии и нейрохирургии осуществляется комплекс консультативно-диагностических мероприятий с отбором пациентов для лечения БТ с последующим динамическим наблюдением. Инъекции БТ проводятся в условиях 4 городской клинической больницей им. Н.Е. Савченко.
Представляем клиническое наблюдение заболевания больной О., 40 лет, поступившей в 2009 г. в неврологическое отделение Республиканского научно-практического центра неврологии и нейрохирургии Минздрава Беларуси с жалобами на частое императивное мочеиспускание от 17 до19 раз в сутки, причем 3-4 раза во время сна с недержанием мочи, что являлось одним из основных факторов, ограничивающих социальную и трудовую активность больной [10].
Анамнез заболевания. В 1996 г. в автоаварии получила сочетанную черепно-мозговую (ушиб головного мозга) и спинальную травму. Остро развилась нижняя вялая параплегия, утратилась чувствительность на туловище ниже уровня пупка и в нижних конечностях, возникла задержка мочи. Выявлен перелом первого поясничного позвонка 3ст. Неоднократно оперирована в Белорусском НИИ травматологии и ортопедии: декомпрессия спинного мозга (1996 г.), корпородез L1 позвонка аутотрансплантантом (2002 г.), установка транспедикулярного фиксатора «Медбиотекс» (2004 г.). Отведение мочи осуществлялось по катетеру Фолея. Через 6 месяцев лечения появилась легкая спастичность в задней группе мышц бедер, восстановилось уретральное мочеиспускание, что указывало на окончание периода спинального шока. Несмотря на улучшение чувствительности по передней поверхности бедер и голеней, произвольные движения в нижних конечностях не восстановились. Позывы на мочеиспускание носили императивный характер. Частота мочеиспусканий достигала 8-10 в сутки, причем 2-3 раза в ночное время с пробуждением от сна. Мочеиспускание после появления позыва могла удерживать около 30 мин. В домашних условиях императивное недержание мочи отмечалось в единичных случаях в ночное время. Периодическую катетеризацию не использовала. Эпизодов острой задержки мочи не было. Больная признана инвалидом 1 группы бессрочно.
В 2000 г. без видимой причины спастичность мышц нижних конечностей уменьшилась. Императивные позывы на мочеиспускание при этом стали более выраженными. В 2004 г. при плановом стационарном лечении в НИИ травматологии и ортопедии проведена магнитно-резонансная томография грудного и поясничного отделов позвоночника. Выявлена гидромиелия в дистальных отделах спинного мозга. Компрессии структур дурального мешка не было. Показаний к оперативному лечению не выявлено. Длительность удержания мочи постепенно уменьшалась. На момент обследования В 2009 г. частота мочеиспусканий достигала 18-20 раз в сутки, причем 3-4 раза во время сна. Каждый 2-3-й императивный позыв на мочеиспускание в дневное время и всякий раз в ночное время сопровождался недержанием мочи. Прием М-холиноблокаторов (дриптан, новитропан) в дозе 5 мг 3 раза в день уменьшали выраженность и частоту (до 10-12 раз в сутки) императивных позывов на мочеиспускание, однако эпизоды недержания мочи сохранялись.
Общесоматический статус при поступлении: правильного телосложения. Кожные покровы и видимые слизистые оболочки без особенностей. Тоны сердца ритмичные. Пульс 78 ударов в минуту. Артериальное давление 125/80 мм.рт.ст. Дыхание везикулярное. Живот мягкий, безболезненный. Периферические лимфоузлы не увеличены. Поясничный лордоз усилен, сколиоз 2 степени влево. Сухость кожи ладоней и стоп. Крупный «звездчатый» рубец в пояснично-крестцовой области вследствие заживления пролежня. Легкая пастозность стоп.
В неврологическом статусе при поступлении отмечалась нижняя параплегия. Атрофии мышц ног. На фоне гипотонии в ногах периодически отмечалась легкая спастичность в задней группе мышц. Контрактур не было. Коленные и ахилловые, подошвенные и патологические стопные рефлексы отсутствовали. Болевая гиперэстезия от Т11 с 2-сторон. Гипестезия от L3 с переходом в анестезию всех видов чувствительности от L5-S5 с 2-х сторон. Рефлекс наружного анального сфинктера вызывался. Произвольные сокращения сфинктера отсутствовали. При выполнении разовой катетеризации отмечалось преходящее затруднение проведения уретрального катетера вследствие спастичности НУС.
Анализ дневника мочеиспусканий за 3 суток: позывы императивные со средней частотой мочеиспускания 18 раз в сутки, никтурия (3-4 мочеиспускания), длительность удержания мочи 1-10 минут в зависимости от выраженности позыва, 3-7 эпизодов неудержания мочи в дневное время в среднем объеме до 50 мл. Недержание мочи периодически провоцировалось физической нагрузкой (пересаживание с кровати в кресло-коляску) и сопровождалось ургентностью. Периодически отмечалось затруднение инициации мочеиспускания. При этом больная провоцировала мочеиспускание легким постукиванием или давлением в надлобковой области. Средний объем мочеиспускания составил 50-55 мл. Ультразвуковой контроль остаточной мочи: 25-50 мл. Стресс-недержания мочи при пробе Вальсальвы не выявлено. Заключение: нейрогенная гиперактивность детрузора с явлениями детрузорно-сфинктерной диссинергии?
Уровень качества жизни, связанный с недержанием мочи по визуально-аналоговой 10 балльной шкале составил 1 балл; по шкале I-QoL снизился со 100% до 33%.
Результаты проведенного обследования. Общий и биохимический анализ крови без патологии. Общий анализ мочи: удельный вес- 1020, белок, сахар – не обнаружен, лейкоциты-7-10 в поле зрения, эпителий в большом количестве, бактерии +, слизь +. Клиренс креатинина 37-35 мл/мин, реабсорбция 96-98%. Посев мочи на стерильность: синегнойная палочка 106 чувствительная к офлоксацину, ципрофлоксацину, тобрамицину, амикацину.
УЗИ почек и МП: размеры правой почки 9,6/6,0см, толщина почки 5,6 см, паренхима 1,2 см; левой: 10/5,0 см, толщина 5,1 см, паренхима 1,6 см. Дифференциация структур паренхимы снижена. МП наполнен до 99 см3. Стенка МП повышенной трабекулярности, утолщена до 6 мм. Мочеточниковые выбросы без особенностей, определяются с 2-х сторон.
ЭКГ: синусовый ритм, нормальная электрическая ось сердца, ЧСС 80; изменения в миокарде левого желудочка.
Электронейромиография нервов нижних конечностей: ответы с мало- и большеберцовых нервов с обеих сторон не получены.
После проведенного амбулаторного курса лечения офлоксацином в таблетках в суточной дозе 400 мг №10 в повторном бактериологическом анализе мочи роста бактерий не было.
При повторной госпитализации проведено дообследование:
Водная цистометрия: (уродинамическая система Duet Logic G2 Medtronic, Дания): ощущение наполнения МП – 19 мл; формирование позыва на мочеиспускание с появлением фазной гиперактивности детрузора – 94 мл; появление выраженного императивного позыва на фоне фазного повышения внутридетрузорного давления до 92 см Н2О – 109 мл; подтекание мочи при наполнении МП до 117 мл. Растяжимость мочевого пузыря оценивалась до момента появления непроизвольных сокращений детрузора: 23 мл/см Н2О. Заключение: нейрогенная гиперактивность детрузора с детрузорно-сфинктерной диссинергией (рисунок 4 А).
При ретроградной цистографии объем наполнения составил 100мл (90мл физиологического раствора хлорида натрия, 10 мл урографина), пузырно-мочеточникового рефлюкса не выявлено. Контуры МП ровные.
Осмотр уролога: нейрогенный мочевой пузырь с гиперактивностью детрузора и детрузорно-сфинктерной диссинергией. Хронический пиелонефрит. Хронический цистит, вне обострения.
Клинический диагноз: отдаленные последствия травматического поражения дистальных отделов спинного мозга вследствие перелома L1 позвонка 3ст (1996г.) с наличием нижней вялой параплегии, нарушением функции тазовых органов (нейрогенная гиперактивность детрузора с детрузорно-сфинктерной диссинергией). Хронический пиелонефрит. Хронический цистит, вне обострения.
В связи с сохранением частых императивных позывов на мочеиспускание и эпизодов недержания мочи на фоне приема М-холиноблокаторов, выраженным нарушением социальной адаптации вследствие нарушения мочеиспускания были назначены инъекции в детрузор препарата Диспорт. Под седацией сибазоном 0,5% 2 мл внутривенно эндоскопически проведено введение Диспорта в 20 точек детрузора, исключая устья мочеточников и треугольник Льето, в суммарной дозе 500 Ед. Предварительно флакон Диспорта (500 Ед) был разведен в 10 мл физиологического раствора хлорида натрия. Разовая инъекция содержала 25 Ед (0,5 мл). С целью дренирования МП был установлен катетер Фолея, который был удален через 18 часов. Незначительное геморрагическое отделяемое в моче отмечалось на протяжении первых суток. Осложнений от введения препарата не было. Больная выписана домой в удовлетворительном состоянии.
При амбулаторном наблюдении за больной начала действия препарата БТ-А Диспорт проявилось через 2 недели после инъекции и достигло наибольшей эффективности через 1 месяц. Дневник мочеиспусканий за 3 суток через 4 недели после инъекций Диспорта: выраженность императивных позывов значительно уменьшилась; средняя частота мочеиспускания – 7-8 раз в сутки, никтурии не отмечено; длительность удержания мочи после появления позыва составляла 30-60 минут; отмечен 1 эпизод недержания мочи в дневное время в объеме до 30 мл. Недержание мочи вследствие физической нагрузки (пересаживание с кровати в кресло-коляску) не отмечалось. Сохранялось затруднение инициации мочеиспускания. Мочеиспускание провоцировалось легким постукиванием или давлением в надлобковой области. Средний объем мочеиспускания составил 150 мл (100-200 мл). Ультразвуковой контроль остаточной мочи: 50-75 мл. Стресс-недержания мочи при пробе Вальсальвы не выявлено.
При выполнении контрольной цистометрии через 30 дней после инъекций препарата Диспорт уродинамические параметры улучшились более, чем в 2 раза (рисунок №4 Б): ощущение наполнения МП – 43 мл; формирование позыва на мочеиспускание без появления признаков гиперактивности детрузора – 191 мл; появление выраженного императивного позыва при внутридетрузорном давлении 6 см Н2О – 109 мл; подтекания мочи при наполнении МП до 450 мл не отмечено. Растяжимость мочевого пузыря: 45 мл/см Н2О. При контрольной цистометрии через 3 месяца данные обследования не существенно не изменились.
При ретроградной цистографии (объем наполнения 300 мл физиологического раствора, 20 мл урографина): пузырно-мочеточникового рефлюкса не выявлено. Контуры МП ровные.
Уровень качества жизни, связанный с недержание мочи по визуально-аналоговой 10 балльной шкале увеличился с 1 до 5 баллов; по шкале I-QoL – с 33 до 60 %.
За прошедший период побочного действия препарата Диспорт не отмечалось. Больная при первичной госпитализации была обучена периодической самокатетеризации. С целью улучшения опорожнения МП была рекомендована в дальнейшем 2-х кратная вспомогательная периодическая катетеризация МП перед сном и в утреннее время.
Заключение
НДНМП наряду с моторными и сенсорными нарушениями является одним из основных диагностических признаков патологии спинного мозга, отражающим не только тяжесть повреждения спинальных структур, но и определяющим социальную интеграцию пострадавших в обществе и качество их жизни. Использование стандартизированной терминологии позволяет обеспечить подробный последовательный анализ симптомов и синдромов НДНМП, сформировать и осуществить стратегию дальнейшего диагностического поиска, назначить адекватный комплекс лечебно-реабилитационных мероприятий в каждом индивидуальном случае. При стандартизации терминологии облегчается анализ и сравнение результатов научно-исследовательских работ различных научных коллективов, занимающихся проблемой НДНМП, что способствует внедрению полученных результатов в практическую деятельность.
Комплексное неврологическое и уродинамическое исследование с оценкой рефлексов, замыкающихся на крестцовом уровне, играет значимую роль в диагностике и прогнозировании НДНМП, особенно на стадии регресса явлений спинального шока. При этом проведение УИ является неотъемлемой частью исследования функциональной активности крестцовых сегментов спинного мозга и детализации НДНМП, что в итоге способствует улучшению диагностики уровня и протяженности поражения спинного мозга.
Существующее на современном этапе разнообразие методов лечения позволяет успешно курировать пациентов с НДНМП. При этом своевременность диагностики и раннее формирование наиболее подходящего лечения позволяет избежать возможных осложнений в последующем и повысить качество жизни больных. Достаточная информированность пациентов и их родственников по данной проблеме повышает мотивацию к лечению и улучшает конечный результат.
Использование БТ-А является малоинвазивной, а в большинстве случаев и амбулаторной процедурой в лечении нейрогенных дисфункций мочеиспускания. Наряду со значимой клинической эффективностью, сохраняющейся до 1 года после однократного лечения, осложнения и побочное действие терапии являются редкостью. Снижение детрузорного давления в результате лечения уменьшает вероятность развития тяжелых осложнений со стороны органов мочевыводящей системы, что уменьшает расходы на терапию воспалительных процессов, мочекаменной болезни, гидронефроза, почечной недостаточности и во многом определяет качество жизни пациентов и течение основного заболевания. Возможность амбулаторного введения БТ-А, снижение затрат на медикаменты и предметы ухода при недержании мочи, на лечение вторичных осложнений при спинальной патологии, включая стационарное лечение, обеспечивает экономическую целесообразность данной терапии. Важность внедрения и дальнейшего изучения эффективности терапии БТ-А подкрепляется терапии мическую целесообразность данной терапии. гии, включая стационарное лечение, , осложнения и побочные проявлени и достоверным улучшением качества жизни при тестировании пролеченных пациентов [57].
Необходимость совместной работы в сфере помощи больным с НДНМП врачей разных специальностей (неврологов и нейрофизиологов, нейрохирургов и ортопедов, урологов и гинекологов) обосновывает целесообразность организации специализированных центров по оказанию всесторонней помощи больным с поражением спинного мозга.
Список литературы
1. Аль-Шукри С.Х., Кузьмин И.В. Гиперактивность детрузора и ургентное недержание мочи: пособие для врачей; С.-Петерб. гос. ун-т. им. И.П. Павлова. – СПб., 2001. – 40 с.
2. Вишневский Е. Л., Лоран О. Б., Вишневский А. Е. Клиническая оценка расстройств мочеиспускания. – М.: ТЕРРА, 2001. – 96 с.
3. Данилов В.В., Вольных И.Ю., Данилова Т.И. и др. Обоснование сроков назначения М-холинолитиков при консервативном лечении гиперактивного мочевого пузыря // Урология. – 2006. – № 5. – С. 71–74.
4. Джавад-Заде М. Д., Державин А. М. Нейрогенные дисфункции мочевого пузыря. – М.: Медицина, 1989. — 384 с.
5. Лихачев С.А., Строцкий А.В., Забродец Г.В. Использование препарата ботулотоксина в лечении нейрогенной дисфункции нижних мочевых путей // Клиническая неврология. – 2009. – № 3. – С. 33–37.
6. Лихачев С.А., Строцкий А.В., Забродец Г.В. Корреляции между неврологическим статусом и характером нейрогенной дисфункции мочеиспускания // Неврология и нейрохирургия в Беларуси. – 2010. – №1. – С. 99–115.
7. Лихачев С.А., Строцкий А.В., Забродец Г.В. Основы патогенетической терапии нейрогенной дисфункции нижних мочевых путей // Актуальные проблемы неврологии и нейрохирургии / Под ред. С.А. Лихачева. – 2009. – Вып. 12. – С. 248–260.
8. Лихачев С.А., Строцкий А.В., Забродец Г.В. Современные аспекты стандартизации терминологии при нейрогенных расстройствах мочеиспускания у больных с поражением спинного мозга // Медицинские новости. – 2010. – № 1. – С. 8–14.
9. Лихачев С.А., Строцкий А.В., Забродец Г.В. Способ восстановления мочеиспускания при спинальной патологии с надсакральным уровнем патологии // Официальный бюллетень: Изобретения, полезные модели, промышленные образцы – 2009. – 4–69. – С. 72.
10. Лихачев С.А., Строцкий А.В., Забродец Г.В., Рагузин А.А. Первый опыт лечения нейрогенной гиперактивности детрузора препаратом ботулотоксина А Диспорт в Беларуси // Медицинские новости. – 2010. – № 1. – С. 35–38.
11. Лопаткин Н.А. Спинальный мочевой пузырь // Руководство по урологии: В 3-х т. Т.2 / Под ред. Н.А. Лопаткина. – М.: Медицина, 1998. – с. 251 – 258.
12. Лопаткин Н.А., Вишневский Е.П. Нейрогенная дисфункция мочевого пузыря // Руководство по урологии: В 3-х т. Т.2 / Под ред. Н.А. Лопаткина. – М.: Медицина, 1998. – С. 232–250.
13. Мазо Е.Б., Кривобородов Г.Г., Школьников М.Е. Ботулинический токсин у больных с нейрогенной дисфункцией нижних мочевых путей // Урология. – 2004. – № 4. – С. 44–48.
14. Савченко Н.Е., Мохорт В.А. Нейрогенные расстройства мочеиспускания. — Минск: Беларусь, 1970. — 244 с.
15. Хейнманн Ф.Б. Иннервация мочевыводящих органов. — Минск: Наука и техника, 1973. — 224 с.
16. Яриков Д.Е. Международные стандарты в оценке неврологических нарушений при травме позвоночника и спинного мозга / Д.Е. Яриков, И.Н. Шевелев, А. В. Басков // Вопросы нейрохирургии. – 1999. – № 1. – С. 36–38.
17. Abrams P. Urodynamics / London: Springer, 2006. – 339 p.
18. Abrams P., Cardozo L., Fall M. at al. The standartisation of terminology in lower urinary tract function: report from the Standardisation Sub-committee of the International Continence Society // Neurourol. Urodyn. – 2002. – Vol. 21. – P.167–178.
19. Amend, B. Effective treatment of Neurogeic Detrusor Dysfunction by combined high-dosed antimuscarinics without increased side-effects / B. Amend [at al.] // European Urology. – 2008. – Vol. 53. – P. – 1021 –1028.
20. Apostolidis A., Dasgupta P., Fowler C.J. Proposed mechanism for the efficacy of injected botulinum toxin in the treatment of human detrusor overactivity // Eur Urol. – 2006. – Vol. 49. – P. 644–650.
21. Apostolidis A., Haferkamp A., Aoki A.R. Understanding the Role of Botulinum Toxin A in the Treatment of the Overactive Bladder More than Just Muscle Relaxation // Eur Urol. – 2006. – Suppl. 5. – P. 670–678.
22. Bladder management for adults with spinal cord injury: a clinical practice guideline for health-care providers / consortium for spinal cord medicine [Electronic resource]. – Paralyzed Veterans of America, 2006. – Mode of access: http://www.pva.org/site/DocServer/Bladder. WEB.pdf?docID=1101.
23. Burns A.S., Rivas D.A., Ditunno J.F. The management of neurogenic bladder and sexual dysfunction after spinal cord injury // Spine. – 2001. – Vol. 26 (Suppl). – P. 129–136.
24. Chapple Ch., Khullar V., Gabriel Z. at al. The effects of antimuscarinic treatments in overactive bladder: an update of a systematic review and meta-analysis // Eur. Urol. – 2008. – Vol. 54, № 3. – P. 543–562.
25. Curt A., Rodic B., Schurch B. et al. Recovery of bladder function in patients with acute spinal cord injury: significance of ASIA scores and somatosensory evoked potentials // Spinal Cord. – 1997. – Vol. 35, № 6. – Р. 368–373.
26. Dykstra D.D. Use of Botulinum Toxin in Urologyc Disorder // Scientific and therapeutic aspects of Botulinum toxin / edited by M. F. Brin, J. Jancovic, M. Hallett-Lippincott. – Philadelphia: Williams and Wilkins, 2002. – P. 351–356.
27. Dykstra D.D., Sidi A.A., Scott A.B. et al. Effects of botulinum A toxin on detrusor-sphincter dyssynergia in spinal cord injury patients // J Urol. – 1988. – Vol. 139. – P. 919–922.
28. Fowler C. Intravesical treatment of overactive bladder // Urology. – 2000. – Vol. 55, № 5A. – P. 60–64.
29. Frawley H. Pelvic floor muscle strength testing // Australian Journal of Physiotherapy. – 2006. – Vol. 52. – P.307.
30. Game X., Castel-Lacanal E., Bentaleb Y., at al. Botulinum toxin A detrusor injections in patients with Neurogeic Detrusor Overactivity significantly decrease the incidence of symptomatic urinary tract infections // Eur Urol. – 2008. –Vol. 53. – P. 613 – 619.
31. Giannantoni A., Di Stasi S.M., Stephen R.L. et al. // J. Urol. – 2004. – Vol. 172. – P. 240–243.
32. Giannantoni A., Scivoletto G., Di Stasi S.M. et al. Clean intermittent catheterization and prevention of renal disease in spinal cord injury patients / Spinal Cord. – 1998. –Vol. 36. – P. 29–32.
33. Griffiths D., Hofner K. et al. Standartization of Terminology of Lower Urinary Tract Function: Pressure-Flow Studies of Voiding, Urethral Resistance and Urethral Obstruction // Neurourol. Urodyn. – 1997. – Vol. 16. – P. 1–18.
34. Groah S.L., Weitzenkamp D., Sett P. at al. The relationship between neurological level of injury and symptomatic cardiovascular disease risk in the aging spinal injured // Spinal Cord. – 2001. – Vol. 39, № 6. – P.310–317.
35. Groat W.C., Booth A.M. Autonomic systems to the urinary bladder and sexual organs // Peripheral neuropathy. – Vol. 1. / edited byP.J. Dyck [at al.]. – W.B. Saunders Company, 1984. – Vol. 1. – P. 285–299.
36. Grosse J., Kramer G., Stohrer M. Success of Repeat Detrusor Injections with Severe Neurogeic Detrusor Overactivity and Incontinence // Eur Urol. – 2005. – Vol. 47. – P. 653–659.
37. Harper M., Fowler C.J., Dasgupta P. Botulinum toxin and its applications in the lower urinary tract // BJU Int. – 2004. – Vol. 93. – P. 702–706.
38. Kaplan S.A., Chancellor M.B., Blaivas J.G. Bladder and sphincter behavior in patients with spinal cord lesion // J. Urol. – 1991. – Vol. 146, № – P. 113–117.
39. Karsenty G., Boy S., Reits A. et al. Botulinum toxin-A (BTA) in the treatment of neurogenic detrusor overactivity incontinence (NDOI)—a prospective randomized study to compare 30 vs. 10 injection sites. International Continence Society Annual Meeting, Montreal, Canada, Aug. 31-Sep. 2, 2005 (abstract no. 93).
40. Kawano P.R., Amaro J.L., Silva F.S. at al. Conventional Urodynamics versusSimplified Cystometry for Characterization of Female Urinary Incontinence // RBGO. – 2004. – Vol. 26, № 4. – P. 311–316.
41. Kessler T. M., Madersbacher H., Kiss G. Prolonged sacral neuromodulation testing using permanent leads: a more reliable patient selection method? // Eur Urol. – 2005. – Vol. 47. – P. 660–665.
42. Kuo H.C. Clinical effects of suburothelial injection of botulinum A toxin on patients with nonneurogenic detrusor overactivity refractory to anticholinergics // Urology. – 2005. – Vol. 66. – P. 94–98.
43. Madersbacher H. The various types of neurogenic bladder dysfunction: an update of current therapeutic concepts // Paraplegia. – 1990. – Vol. 28. – P. 217–229.
44. Maria G., Cadeddu F., Brisinda D. et al. Management of bladder, prostatic and pelvic floor disorders with botulinum neurotoxin // Curr Med Chem. – 2005. – Vol. 12. – P. 247–265.
45. Martin J.L., Williams K.S., Abrams K.R. at al. Systematic review and evaluation of methods of assessing urinary incontinence // Health Technol. Assess. – 2006. – Vol. 10, № 6. – P. 1–132.
46. Maynard F.M., Bracken M.B., Creasey G et al. International Standards for Neurological and Functional Classification of Spinal Cord Injury // Spinal Cord. – 1997. – Vol. 35, № 5. – Р. 266– 274
47. Ockrim J., Laniado M.E., Khoubehi B., Renzetti R. at al. Variability of detrusor overactivity on repeated filling cystometry in men with urge symptoms: comparison with spinal cord injury patients // BJU Int. – 2005. – Vol. 95, № 4. – P. 87–90.
48. Patel A., Patterson J., Chapple Ch. Botulinum Toxin Injection for Neurogenic and Idiopatic Detrusor Overactivity: A Critical Analysis of Results // Eur Urol. – Vol. 50. – 2006. – P. 684–710.
49. Penders J., Huylenbroeck A.A.Y., Everaert K. at al. Urinary infections in patients with spinal cord injury // Spinal Cord. – 2003. – Vol. 41, № 10. – P. 549–552.
50. Perkash I., Linsenmeyer T.A., Bodner D.R. at al. Detrusor-sphincter dyssynergia and vesico urethral reflux: management / I. Perkash [.] // Spinal Cord. – 1998. – Vol. 36, № 1. – P. 2–5.
51. Petit H., Wiart L., Gaujard E. at al. Botulinum A toxin treatment for detrusor-sphincter dyssynergia in spinal cord disease // Spinal Cord. – 1998. – Vol. 36. – Р. 91–94.
52. Reitz A., Denys P., Fermanian Ch. at al. Do repeat intradetrusor Botulinum toxin type A injections yield valuable results? Clinical and urodynamics results after five injections in patients with Neurogeic Detrusor Overactivity // Eur Urol. – 2007. – Vol. 52. – P. 1729–1735.
53. Sacomani C.A.., Trigo-Rocha F.E., Gomes C.M. at al. Effect of the trauma mechanism on the bladder-sphincteric behavior after spinal cord injury // Spinal Cord. – 2003. – Vol. 41, № 1. – P. 12–15.
54. Schäfer W., Abrams P., Liao L. at al. Good Urodynamic Practices: Uroflowmetry, Filling Cystometry and Pressure-Flow Studies // Neurourol. Urodyn. – 2002. – Vol. 21. – P. 261–274.
55. Schurch B, Schmid D., Stohrer M. Treatment of neurogenic incontinence with botulinum toxin A // N Engl J Med. – 2000. – Vol. 342. – P. 665.
56. Schurch B., De Seze M., Denys P. et al. Botulinum toxin type A is a safe and effective treatment for neurogenic urinary incontinence: results of a single treatment, randomized, placebo controlled 6-month study // J Urol. – 2005. – Vol. 174. – P. 196–200.
57. Schurch B.,Denys P., Kozma Ch.M. at al Botulinum Toxin A improves the quality of life of patients with neurogenic urinary incontinence // Eur Urol. – 2007. – Vol. 52. – P. 850 – 859.
58. Schurch B., Schmid D.M., Kaegi K. Value of sensory examination in predicting bladder function in patients with T12-L1 fractures and spinal cord injury // Arch. Phys. Med. Rehabil. – 2003. – Vol. 84, № 1. – P. 83–89.
59. Schurch B., Schmid D.M., Karsenty G. at al. Can neurologic examination predict type of detrusor sphincter-dyssynergia in patients with spinal cord injury? // Urology. – 2005. – Vol. 65, № 2. – P. 243–246.
60. Schurch B., Stohrer M., Kramer G. et al. Botulinum-A toxin for treating detrusor hyperreflexia in spinal cord injured patients: a new alternative to anticholinergic drugs? Preliminary results // J Urol. – 2000. – Vol. 164. – P. 692–697.
61. Silva C., Silva J., Ribeiro M-J. at al. Urodynamic effect of intravesical resiniferatoxin in patients with Neurogeic Detrusor Overactivity of spinal origin: results of a double-blind randomized placebo-controlled triale // Eur. Urol. – 2005. – Vol. 48. – P. 650–655.
62. Stohrer M., Castro-Diaz D., Chartier-Kastler E. et al. Guidelines on neurogenic lower urinary tract dysfunction / European Association of Urology, 2003.
63. Stöhrer M., Goepel M., Kondo A. at al. The standardization of terminology in neurogenic lower urinary tract dysfunction with suggestions for diagnostic procedures // Neurourol. Urodyn. – 1999. – Vol. 18. – P. 139–158.
64. Sutherst J.R., Brown M.C. Comparison of single and multichannel cystometry in diagnosing bladder instability / BMJ. – 1984. – Vol. 288. – P. 1720–1722.
65. Suzuki T., Ushiyama T. Vesicoureteral reflux in the early stage of spinal cord injury: a retrospective study // Spinal Cord. – 2001. – Vol. 39. – P. 23–25.
66. Swash M. The conus medullaris and sphincter control // Diseases of the Spinal Cord; edited by E. Gritchley, A. Eisen. – Springer-Verlag London Limited, 1992.
67. Textbook of female urology and urogynecology / edited by L. Cardozo [at al.]. – UK: Informa Healthcare, 2006. – 1384 p.
68. Weld K.J., Dmochowski R.R. Effect of bladder management on urological complications in spinal cord injured patients / J Urol. – 2000. – Vol. 163. – P. 768–772.
69. Weld K.J., Dmochowski R.R. Association of level of injury and bladder behavior in patients with post-traumatic spinal cord injury // Urology. – 2000. – Vol. 55, № 4. – P. 490–494.
70. Weld K.J., Graney M.J., Dmochowski R.R. Clinical significance of detrusor sphincter dyssynergia type in patients with post-traumatic spinal cord injury // Urology. – 2000. – Vol. 56, № 4. – P. 565–568.
71. Wyndaele J.J. Complications of intermittent catheterization: their prevention and treatment // Spinal Cord. – 2002. – Vol. 40, № 10. – P. 536–541.
72. Wyndaele J.J. Correlation between clinical neurological data and urodynamic function in spinal cord injured patients // Spinal Cord. – 1997. – Vol. 35, № 4. – P. 213–216.
73. Wyndaele J.J., THi H.Vo., Pham B.C. at al. The use of one-channel water cystometry in patients with a spinal cord lesion: practicalities, clinical value and limitations for the diagnosis of neurogenic bladder dysfunction // Spinal Cord. – 2009. – Vol. 47, № 7. – P. 526–530.
Приложение
Рисунки

Рисунок 1. Иннервация нижних мочевых путей (L. Cardozo, 2006).

Рисунок 2. Классификация нейрогенной дисфункции НМП (по Madersbacher)
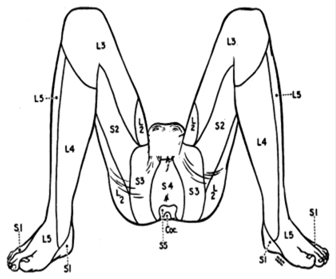

Рисунок 3. Дерматомы и рефлексы (коленный L2-4, ахиллов L5-S2, анальный S4-5, кремастерный, бульбокавернозный L5-S5) [62] .
|
|
|
|


Рисунок № 3 (А). Водная цистометрия до лечения (уродинамическая система Duet Logic G2 Medtronic, Дания). FD – ощущение наполнения мочевого пузыря (19 мл); ND – четко сформированный позыв (94 мл); SD – выраженный императивный позыв (109 мл); подтекание мочи (117 мл). Растяжимость мочевого пузыря оценивалась до появления непроизвольных сокращений детрузора (НСД): 23 мл/см Н2О.

Рисунок № 3 (Б). Водная цистометрия, контрольное исследование через 30 дней (уродинамическая система Duet Logic G2 Medtronic, Дания). FD – ощущение наполнения мочевого пузыря (43 мл); ND – четко сформированный позыв (191 мл); SD – выраженный позыв (240 мл); подтекания мочи при наполнении до 450 мл не отмечено. Растяжимость мочевого пузыря: 45 мл/см Н2О.
Таблицы
| Формы неврогенных расстройств мочеиспускания | Тип НМП |
| Корковая Врожденно-дисгенетическая Травматическая Функциональная | Корковый незаторможенный пузырь |
| Спинальная (медуллярная) Врожденно-дисгенетическая Травматическая Воспалительно-дегенеративная | Рефлекторный спинальный Арефлекторный (атоничный) спинальный Неадаптированный спинальный Смешанный спинальный |
  Экстрамедуллярная проводниково-ганглионарная
Врожденно-дисгенетическая
Травматическая Экстрамедуллярная проводниково-ганглионарная
Врожденно-дисгенетическая
Травматическая
| Арефлекторный (атоничный) Неадаптированный Смешанный (арефлекторно- неадаптированный) |
| Органно-ганглионарная Врожденно-дисгенетическая Травматическая Воспалительно-дегенеративная | Арефлекторно-атонический первичный Вторично-смешанный спастический |
Таблица 1. Классификация нейрогенных дисфункций мочевого пузыря (Н.Е. Савченко, В.А. Мохорт, 1984).
| Сегменты спинного мозга | Ключевые мышцы для тестирования | |
| С5 | сгибание в локте (m.biceps, m.brachialis); | |
| С6 | разгибание кисти (m.extensor carpi radialis longus and brevis); | |
| С7 | разгибание в локте (m.triceps); | |
| С8 | сгибатели пальцев (m.flexor digitorum profundus) оцениваются по сгибанию дистальной фаланги среднего пальца; | |
| Т1 | отведение мизинца (m.abductor digiti minimi); | |
| L2 | сгибание бедра (m.iliopsoas); | |
| L3 | разгибание в колене (m.quadriceps); | |
| L4 | тыльное сгибание стопы (m.tibialis anterior); | |
| L5 | разгибание большого пальца (m.extesor hallucis longus); | |
| S1 | сгибание стопы (m.gastrocnemius, soleus). | |
Таблица 2. Ключевые мышцы для тестирования.
| Модифицированная шкала Oxford | |
| 0 баллов | нет сокращения МТД |
| 1 балл | минимальное циркулярное сокращение без втяжения |
| 2 балла | слабое сокращение без втяжения |
| 3 балла | сокращение умеренной силы с втяжением перинеальной области, но без оказания сопротивления при противодействии |
| 4 балла | хорошая способность к втяжению перинеальной области с оказанием некоторого сопротивления |
| 5 баллов | сильное циркулярное сокращение мышц с втяжением перинеальной зоны при достаточном сопротивлении |
Таблица 3. Модифицированная шкала Oxford по оценке силы мышц тазового дна.
| Восстановление уретрального мочеиспускания (группа 1) | Сохранение задержки мочи (группа 2) | |
| Пол (муж/жен; кол-во больных) | 8/31 | 12/29 |
| Возраст (лет) | 41,5±15,2 | 40,4±17,0 |
| Травматический/нетравматический генез патологии (кол-во больных) | 16/23 | 19/22 |
| Давность патологии (недели) [медиана, 25-75%] | 8 (3-13) | 6,57 (3-11) |
| Период наблюдения (дни) | 34,3±16,5 | 38,9±17,0 |
Таблица 4. Сравнение групп по возрасту, половой принадлежности, давности патологии и периоду наблюдения.
|
| Восстановление уретрального мочеиспускания (группа 1) | Сохранение задержки мочи (группа 2) | ||
| поступление | выписка | поступление | выписка | |
| Моторный балл | 62,0±27,8 | 64,2±26.7** | 44,5±20,4* | 46,3±18,0* |
| Чувствительный балл (в %) | 69,3±20,7 | 70,6±19,7 | 54,3±18,7* | 55,9±19,4* |
| Ранги тяжести АВ/СД | 18-6/3-12 | 13-7/5-14 | 22-6/11-2 | 25-6/7-3* |
| балл Ashworth (средний по группе) | 0,9 | 1,2 | 0,7 | 1,1 |
| Произвольное сокращение НАС (да/нет) | 13/26 | 15/24 | 4/37* | 2/39* |
Таблица 5. Динамика моторного и чувствительного баллов в сравниваемых группах больных.
* Достоверное различие (р<0,05) между группами
** Достоверное различие (р<0,05) внутри группы
Диаграммы

Диаграмма 1. Распределение тяжести спинальной патологии по неврологическим уровням.


Диаграмма 2. Доля больных со сформированным рефлексом детрузора при различных степенях рефлекторности НАС. А – в группе №1 с восстановленным уретральным мочеиспусканием. Б – в группе с сохраняющейся задержкой мочи (№2).
|
из
5.00
|
Обсуждение в статье: Клинический пример применения Ботулотоксина типа А при нейрогенной дисфункции нижних мочевых путей |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

