 |
Главная |
Растворы электролитов.
|
из
5.00
|
При изучении законов Рауля и Вант-Гоффа скоро выяснилось, что многие вещества дают отклонения от этих законов, причем всегда в положительную сторону. Вант-Гофф даже ввел поправочный коэффициент i, который он назвал изотонический. К тому же растворы таких веществ проводят электрический ток. Поэтому такие растворы назвали растворами электролитов. Электролит – вещество, раствор или расплав которого проводит электрический ток. Таким образом, для растворов электролитов законы имеют вид:
Росм = iCRT 1.10
где: Росм – осмотическое давление, i – изотонический коэффициент, С – молярная концентрация раствора, Т – абсолютная температура, R – универсальная газовая постоянная.
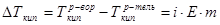 1.11
1.11
где: 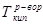 ,
, 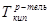 - температуры кипения раствора и растворителя, соответственно, i – изотонический коэффициент, Е – эбулиоскопическая постоянная (для воды Е=0,52), m – моляльная концентрация раствора.
- температуры кипения раствора и растворителя, соответственно, i – изотонический коэффициент, Е – эбулиоскопическая постоянная (для воды Е=0,52), m – моляльная концентрация раствора.
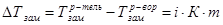 1.12
1.12
где 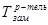 ,
, 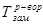 - температуры замерзания (кристаллизации) растворителя и раствора, соответственно, i – изотонический коэффициент, К – криоскопическая постоянная (для воды К=1,86), m – моляльная концентрация раствора.
- температуры замерзания (кристаллизации) растворителя и раствора, соответственно, i – изотонический коэффициент, К – криоскопическая постоянная (для воды К=1,86), m – моляльная концентрация раствора.
Чтобы объяснить эти факты, Сванте Аррениус предположил, что электролиты в растворе под действием растворителя распадаются на ионы. Этот процесс он назвал электролитической диссоциацией, т.е. ApBq→pA+ + qB-. Однако, такой подход приводит к тому, что изотонический коэффициент должен быть целочисленным, что противоречит опытным данным. Тогда он предположил, что наряду с процессом электролитической диссоциации идет обратный процесс, названный им процессом электролитической ассоциации, т.е. pA+ + qB- →ApBq. Так как в растворе эти процессы протекают одновременно, то устанавливается равновесие:
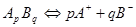 1.13
1.13
В качестве характеристики этого равновесия Аррениус ввел степень электролитической диссоциации α, которую определил так:
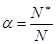 , где N* - число молекул электролита, распавшихся на ионы, N – исходное число молекул электролита. α меняется от 0 до 1 или от 0% до 100%. Степень диссоциации электролита зависит от его концентрации и природы как электролита, так и растворителя.
, где N* - число молекул электролита, распавшихся на ионы, N – исходное число молекул электролита. α меняется от 0 до 1 или от 0% до 100%. Степень диссоциации электролита зависит от его концентрации и природы как электролита, так и растворителя.
Связь между α и i имеет для электролита ApBq вид:
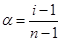 1.14
1.14
где: α – степень электролитической диссоциации, i –изотонический коэффициент, n – число ионов, на которые распадается электролит (для электролита ApBq n=p+q).
Таким образом, по величине осмотического давления или по температурам кипения и замерзания раствора электролита можно определить его степень диссоциации, сравнив экспериментальные величины с рассчитанными по формулам для идеальных растворов неэлектролитов. Однако, определенную таким образом степень диссоциации называют кажущейся степенью диссоциации. Причины этого будут рассмотрены ниже.
Пример 10. Раствор, содержащий 0,85 г ZnCl2 в 125 г воды, замерзает при –0,23оC. Определить кажущуюся степень диссоциации, если Kкр =1,86.
РЕШЕНИЕ. Находим моляльную концентрацию m соли в растворе. Поскольку мольная масса ZnCl2 = 65 + 35,2 = 136 г/моль, то m = (0,85 * 1000):(136 * 125) = 0,05 моль/кг; определим понижение температуры замерзания: Dtзам = Kкр * m = 1,86 * 0,05 = 0,093оC; сравним найденное Dtзам с экспериментальным:
i = Dtзам.эксп./Dtзам = 0,23/0,093 = 2.47.
Теперь находим кажущуюся степень диссоциации: a = (i – 1)(n – 1), для ZnCl2 (Zn2+ + 2Cl-) n = 3, a = (2,47 – 1)(3 – 1) = 0,735.
Дальнейшее развитие теория растворов электролитов получила после появления фундаментальных работ по сольватации, согласно которым процесс электролитической диссоциации протекает с образованием сольватированных (гидратированных) ионов. Например, процесс диссоциации HNO3 в воде будет протекать следующим образом:
HNO3 + (n+m)H2O ó H+·nH2O + NO3-·mH2O.
Однако, в дальнейшем, для упрощения записей вода будет опущена.
Электролитическая диссоциация зависит от растворителя: одно и тоже вещество в одном растворителе диссоциирует хорошо, а в другом - плохо. Например, NaI в воде диссоциирует нацело, а в ацетоне – очень плохо. Поэтому, в дальнейшем, рассматривать будем только водные растворы электролитов.
Все водные растворы электролитов по степени диссоциации можно разбить на три группы:
1. Сильные электролиты, степень диссоциации которых α>0,3 (α>30%). К ним относятся все растворимые соли, кроме солей Hg, все щелочи, и ряд кислот, например: H2SO4, HNO3, HCl, HBr, HI, HClO3, HClO4, HMnO4, H2CrO4, H2Cr2O7. Отметим, что, несмотря на то, что AgOH не существует, он бы был сильным электролитом.
2. электролиты средней силы, степень диссоциации которых 0,03<α≤0,3 (3%<α≤30%). К ним можно отнести H2SO3, H3PO4, HF.
3. слабые электролиты, степень диссоциации которых α≤0,03 (α≤3%). К ним относятся все нерастворимые основания, все органические электролиты, например уксусная кислота (СН3СООН), NH4OH, H2CO3, HClO, HCN, H2S, H2SiO3, HNO2, H2O.
|
из
5.00
|
Обсуждение в статье: Растворы электролитов. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

