 |
Главная |
В случаях, когда способ выражения концентрации явно не указан, то исполь-зуется моляльность.
|
из
5.00
|
Закон эквивалентов для растворов имеет вид:
V1*C1=V2*C2 1.3
Где: V1,V2-объемы 1-го и 2-го растворов, соответственно,
С1,С2-нормальные концентрации 1-го и 2-го раствора, соответственно.
Пример 1. Сколько миллилитров 0,3Н раствора NaCl надо прибавить к 150 мл 0,16Н раствора AgNO3, чтобы осадить все находящееся в растворе серебро в виде AgCl?
РЕШЕНИЕ. Обозначим неизвестный объем раствора NaCl через x и составим пропорцию: x * C1 = V2 * C2;
X * 0,3 = 150 * 0,16;
X = 150 * 0,16/0,3 = 80 мл
Пример 2. Какова молярность 6Н раствора Al2(SO4)3?
РЕШЕНИЕ. 6Н концентрация означает, что в 1000 мл раствора содержится 6 моль эквивалентов Al2(SO4)3. Моль эквивалентная масса Al2(SO4)3 = (мольная масса)/(3*2), т.е. один моль эквивалент Al2(SO4)3 в шесть раз меньше его мольной массы. Следовательно, если в 1000 мл раствора содержится 6 моль эквивалентов Al2(SO4)3, то это соответствует 1 М концентрации ( 1 молю в 1000мл раствора).
Пример 3. Сколько миллилитров H2SO4 с концентрацией 14,35%,имеющей плотность d = 1,14 мл, потребуется для приготовления 250 мл 0.1Н раствора?
РЕШЕНИЕ. 0,1Н концентрация означает, что в 1000 мл раствора содержится 0,1 моль эквивалент H2SO4, а в 250 мл – 0,025 моль эквивалента:
1000 мл – 0,1 Э
250мл - x x = 250 * 0,1/1000 = 0,025, т.к моль эквивалентная масса H2SO4 98:2 = 49 г/моль, масса H2SO4 будет 49 * 0,025 = 1,225 г. 14,35%-ная концентрация означает, что в 100 граммах раствора содержится 14,35 г H2SO4:
100 г – 14,35 г H2SO4
x г – 1,225 г
x = 1,225 * 100/14,35 = 8,54 г.
Плотность раствора d = 1,1 г/мл, следовательно, 8,54 г соответствуют 8,54/1,1 = 7,76 мл.
Пример 4. Сколько граммов Ca(OH)2 надо взять для приготовления300 г 25%-го раствора?
РЕШЕНИЕ. Необходимо приготовить 25%-ный раствор, т.е. по определению процентной концентрации, в 100 г раствора должно содержаться 25 г Ca(OH)2. Тогда в 300 г раствора должно содержаться (300 * 25) / 100 = 75 г Ca(OH)2 и соответственно 225 г воды.
Пример 5. Сколько грамм H2SO4 потребуется для приготовления 5 л 0,3 М раствора ?
РЕШЕНИЕ. По определению молярной концентрации, в 1 л раствора должно содержаться 0,3 моля H2SO4, тогда в 5 л : 0,3 * 5 = 1,5 моля, что составляет 98 * 1,5 = 147 г H2SO4, где 98 г/моль – мольная масса H2SO4.
ОТВЕТ: 147 г H2SO4 потребуется для приготовления 5 л 0,1М раствора.
Пример 6. Какова мольная доля (x2) 10% раствора КОН ?
РЕШЕНИЕ. В 100 граммах раствора содержится 90 грамм Н2О и 10 грамм КОН. Количество молей воды (n1) = 90/18 =5, количество молей КОН (n2) = 10/56=0.1786, где 18 и 56 молекулярные массы Н2О и КОН, соответственно. Число молекул воды в 100 граммах такого раствора =n1*NA, число молекул КОН =n2*NA, где NA –число Авогадро. Тогда общее число молекул в 100 граммах такого раствора = (n1 + n2)*NA и, следовательно, 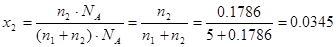
Пример 7. Чему равна моляльность, молярность, нормальность и мольные доли 48% раствора H2SO4, плотность которого d=1.38 г/см3 ?
РЕШЕНИЕ. Допустим, что имеется 1 литр такого раствора. Тогда его масса = 1000*1.38=1380 г. Масса H2SO4(m2) в этом растворе составляет m2 = 1380*0.48=662.4 г, а масса воды m1 =1380-662.4=717.6 г. определим, какая масса H2SO4 приходится на 1000 г воды. Для этого решим пропорцию:
662.4 г H2SO4 приходится на 717.6 г воды
X г H2SO4 приходится на 1000 г воды
Откуда X=923.077 г. Разделив это число на молекулярную массу H2SO4, мы получим моляльность раствора, т.е.: 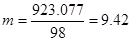 М/кг. Для определения молярности нужно массу H2SO4 разделить на величину ее молекулярной массы, т.е.
М/кг. Для определения молярности нужно массу H2SO4 разделить на величину ее молекулярной массы, т.е. 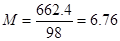 М/л. так как МЭH2SO4 =
М/л. так как МЭH2SO4 = 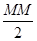 , то нормальность получим, умножив молярность на 2, т.е.
, то нормальность получим, умножив молярность на 2, т.е. 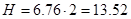 МЭ/л. для нахождения мольных долей, определим сначала число молей воды (n1) и H2SO4 (n2): очевидно,
МЭ/л. для нахождения мольных долей, определим сначала число молей воды (n1) и H2SO4 (n2): очевидно, 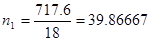 , а
, а 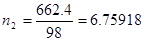 , тогда (см. пример 6)
, тогда (см. пример 6) 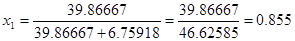 03,
03, 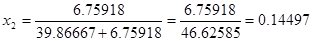
В дальнейшем, для разбавленных растворов будет использоваться, в основном, молярность, а не моляльность, поскольку для разбавленных растворов эти величины достаточно близки друг к другу.
Свойства растворов
Все растворы обладают некоторыми свойствами, которые практически зависят только от соотношения числа частиц компонентов раствора и не зависят от природы частиц. Общие свойства раствора – это свойства идеального раствора.
Идеальным называется раствор, образованный компонентами, имеющими строго одинаковые размеры частиц и строго одинаковую энергию межмолекулярного взаимодействия.
Основными законами, описывающими свойства растворов, являются: закон Генри, законы Рауля (1-й, 2-ой, 3-ий), осмотический закон Вант-Гоффа. Следует отметить, что эти законы выполняются только для разбавленных растворов.
Все растворы независимо от агрегатного состояния обладают способностью к диффузии. Диффузией называется свойство вещества равномерно распределяться по всему предоставленному ему объему. Скорость диффузии (скорость выравнивания концентрации по объему) в газах велика, в твердых телах при обычных температурах диффузия длится годы. В растворах диффузия протекает за десятки часов, для небольших порядка литра объемов раствора.
Если в сосуд налить концентрированный раствор, а сверху добавить чистый растворитель, то начнется процесс диффузии, как растворителя, так и растворенного вещества до полного выравнивания концентрации по всему объему.
Можно создать условия, когда диффузия идет только по растворителю. Для этого разделим раствор и чистый растворитель пленкой, через которую могут проходить только молекулы растворителя. Такие пленки называются полупроницаемыми мембранами.
Процесс односторонней диффузии растворителя через полупроницаемую мембрану называется осмосом.
При односторонней диффузии растворителя в раствор, объем последнего начинает увеличиваться, что влечет за собой увеличение гидростатического давления, которое препятствует диффузии растворителя. При некотором давлении наступает равновесие: сколько молекул растворителя проникло в раствор, столько же выталкивается из него увеличившимся давлением.
Равновесное давление раствора, препятствующее диффузии растворителя через полупроницаемую мембрану, называется осмотическим давлением.
|
из
5.00
|
Обсуждение в статье: В случаях, когда способ выражения концентрации явно не указан, то исполь-зуется моляльность. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

