 |
Главная |
Способы устранения жесткости.
|
из
5.00
|
Процесс устранения жесткости получил название умягчение воды. для умягчения воды в народном хозяйстве, в основном, используются реагентные методы. Наиболее часто применяющиеся из них следующие:
1. Известковый метод. Сущность этого метода состоит в переводе катионов кальция и магния в трудно растворимые соединения с использованием извести. При этом протекают следующие реакции:


Как видно из написанных выше реакций этот метод устраняет только кальциевую карбонатную жесткость, а магниевую – переводит в кальциевую. Поэтому для устранения магниевой жесткости нужно добавлять избыток извести, чтобы связать образующуюся кальциевую жесткость из магниевой.
2. Содовый метод. Сущность этого метода состоит в переводе катионов кальция и магния в трудно растворимые соединения с использованием кальцинированной соды. При этом протекают следующие реакции, написанные в ионном виде:

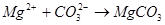
В этом методе происходит устранение как карбонатной, так и некарбонатной жесткости, но он более дорогой, чем известковый. Поэтому на практике его применяют редко, а используют содово-известковый метод.
3. Содово-известковый метод. При его использовании для устранения некарбонатной жесткости в воду добавляется сода, а для устранения карбонатной – известь в избытке, необходимом для устранения магниевой составляющей карбонатной жесткости. Протекающие реакции приведены в методах, описанных выше.
4. Фосфатный метод. Для умягчения воды в этом методе используют чаще всего тринатрицйфосфат (Na3PO4·12Н2О). Протекающие при этом реакции можно представить следующими ионными уравнениями:


Наряду с реагентными методами для умягчения воды применяют и метод ионного обмена. Сущность метода состоит в следующем. Природные, искусственные и синтетические материалы, способные к обмену входящих в их состав ионов на ионы контактирующего с ними раствора, называются ионитами. Иониты, содержащие подвижные катионы, способные к обмену, называются катионитами, а обменивающие анионы – анионитами. Наиболее часто применяются для устранения жесткости воды синтетические иониты.
Основу синтетического ионита составляют полимерные углеводородные цепи с пространственной трехмерной структурой, которые содержат ионогенные (активные) группы. Активные группы вводятся в полимер или непосредственно при его получении, или при последующей химической обработке. Для придания полимеру трехмерной структуры кроме основного исходного мономера в реакционную смесь вводят непредельный углеводород, сшивающий линейные макромолекулы полимера мостиками между собой.
Катиониты по химической природе представляют собой полимерные кислоты или их соли. Рабочей формой катионита может быть кислотная, когда обменивающимися ионами будут ионы Н+ (Н-катионит), или солевая, например натриевая, когда способными к обмену будут ионы Na+ (Na-катионит).
Аниониты являются полимерными основаниями или их солями. Рабочей формой анионита может быть основная, когда способными к обмену ионами анионита будут ионы ОН- (ОН-анионит), или – солевой, когда обменивающимися ионами будут, например, ионы Cl- (Cl-анионит).
Наиболее важной технологической характеристикой служит рабочая (динамическая) емкость. Она определяется количеством ионов (мЭ/л или Э/м3), поглощенных определенным объемом набухшего ионита в процессе фильтрования до момента появления этих ионов в растворе, выходящем из фильтра.
Na-катионирование. Умягчение воды в этом случае происходит в результате замены в эквивалентном количестве ионов Ca2+ и Mg2+ на ионы Na+ катионита:


Н-катионирование. Сущность этого метода состоит в том, что ионы Н+ катионита обмениваются на содержащиеся в растворе ионы Ca2+ и Mg2+. В обработанной воде появляется эквивалентное количество свободных кислот:


Для устранения избыточной кислотности в обработанную воду добавляют гидроксид натрия.
Пример 16. Чему равна общая, карбонатная, некарбонатная жесткость воды, если в 3 литрах ее содержится 0,240 г Mg2+, 0,60 г Ca2+ и 0,813 г HCO3-.
РЕШЕНИЕ. Определяем количество ионов Ca2+, Mg2+ и HCO3- в мг * экв/л, учитывая, что
ЭMg2+ = 24/2 = 12мг, ЭCa2+ = 40/2 = 20 мг, ЭHCO3- = 61/1 = 61 мг;
[Mg2+] = 0,240 г = 240 мг = 240/3 * 12 = 6,7 мэкв/л;
[Ca2+] = 0,60 г = 600 мг = 600/3 * 20 = 10 мэкв/л;
[HCO3-] = 0,183 г = 183 мг = 183/3 * 61 = 1 мэкв/л;
[Ca2+] + [Mg2+] = 6,7 + 10 = 16,7 мэкв/л,
т.к. [Ca2+] + [Mg2+] >[HCO3-], то
Жо = [Ca2+] + [Mg2+] = 16,7 мэкв/л;
Жк = [HCO3-] = 1 мэкв/л;
Жнк = Жо – Жк =16,7 – 1 = 15,7 мэкв/л.
Пример 17. На устранение жесткости 3 л воды пошло 0,318 г Na2CO3. Вычислить общую жесткость воды.
РЕШЕНИЕ. На 3 литра воды пошло 0,318 г Na2CO3, на 1 л – x г Na2CO3.
x = 0,318/3 = 0,106 мг.
Так как эквивалентная масса ЭNa2CO3 = 106 / 2 = 53 мг, 106 мг/л составят 106 / 53 = 2мэкв/л.
Ответ : общая жесткость воды равна 2 мэкв/л
ВАРИАНТЫ КОНТРОЛЬНОГО ЗАДАНИЯ № 1
| Номер варианта | Определить нормальность и молярность раствора соли по процентной концентрации(%) и плотности раствора(d). | Определить температуру кипения и замерзания водного раствора соли, если дана кажущаяся степень диссоциации a Кэб = 0,52, Ккр = 1,86 | Написать уравнения реакций гидролиза солей, если они воз-можны. Написать выражение для константы гидролиза и определить реакцию среды (по значению рН), направление смещения равновесия при разбавлении, добавлении в систему ионов водорода, добавлении в систему гидроксид-ионов, нагревании | Определить все виды жесткости (общую, карбонатную, некарбонатную), если дано А – объем воды (л), В – количество ионов магния (г), С – количество ионов кальция (г), D – количество ионов HCO3- (г) | ||
| % | Соль | d, г/см3 | ||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 121 | 8,7 | MgCl2 | 1,07 | Раствора, содержащего 7,1г Na2SO4 в 100 г воды; a = 0,9 | (NH4)2SO4; Zn(NO3)2; KCl | A = 3, B = 1,2 , C = 0,2 , D = 0,61 |
| 122 | 5 | CaCl2 | 1,06 | 40% -го раствора Na2SO4; a = 0,8 | Na2SO3; Al(NO3)3; K2SO4 | A = 6, B = 0,62 , C = 0,12 , D = 0,366 |
| 123 | 10 | Mg(NO3)2 | 1,153 | Раствора, содержащего 14,2 г Na2SO4 в 1000 г воды; a = 0,8 | NH4Cl; K2SO3; NaNO3 | A = 8, B = 0,096 , C = 0,16 , D = 0,976 |
| 124 | 8,7 | MgCl2 | 1,07 | Раствора, содержащего 33,2 г BaCl2 в 1000 г воды; a = 0.85 | Na2CO3, K2SO4, Pb(NO3)2 | A = 2, B = 0,048 , C = 0,08 , D = 1,22 |
| 125 | 10,7 | Ca(NO3)2 | 1,09 | Раствора, содержащего 58,5 г NaCl в 1000 г воды; a = 0,8 | K2SO3; Fe(NO3)2;NaCl | A = 8, B = 0,96 , C = 0,16 , D = 48,8 |
| 126 | 5,7 | Mg(NO3)2 | 1,04 | 30%-го раствора NaCl; a = 0,9 | K3PO4; FeCl3; KNO3 | A = 4, B = 0,096 , C = 0,12 , D = 0,488 |
| 127 | 15 | Mg(NO3)2 | 1,108 | Раствора, содержащего 87,75 г NaCl в 1000 г воды; a = 0,9 | Ni(NO3)2; Na2SO4; AlCl3 | A = 2, B = 0,024 , C = 0,04 , D = 0,244 |
| 128 | 11 | MgSO4 | 1,115 | Раствора, содержащего 58,5 г NaCl в 1000 г воды; a = 0,8 | AgNO3; Na2CO3;CaCl2 | A = 4, B = 0,48 , C = 0,2 , D = 0,61 |
| 129 | 7 | MgSO4 | 1,05 | 10%-го раствора Na2SO4; a = 0,9 | NH4NO3; K2SO3;BaCl2 | A = 5, B = 0,06 , C = 0,1 , D = 0,305 |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 130 | 10,5 | CaCl2 | 1,08 | Раствора, содержащего 29 г NaCl в 500 г воды; a = 0,8 | Na3PO4; AlCl3; NaCl | A = 0,5, B = 0,012 , C = 0,04 , D = 0,244 |
| 131 | 5 | MgSO4 | 1,05 | Раствора, содержащего 2 моля Na2SO4 в 500 г воды ; a = 0,9 | Na2SiO3; KCl; Fe2(SO4)3 | A = 12, B = 0,12 , C = 0,24 , D = 0,732 |
| 132 | 5 | CaCl2 | 1,05 | Раствора, содержащего 14,2 г Na2SO4 в 500 г воды; a = 0,8 | Al2(SO4)3; Na2SO4; K2SiO3 | A = 4, B = 1,2 , C = 2 , D = 6,1 |
| 133 | 2 | CaCl2 | 1,03 | Раствора, содержащего 1,36 г Na2SO4 в 1000 г воды; a = 0,9 | KNO3; K3PO4; Al(NO3)3 | A = 10, B = 0,6 , C = 0,1 , D =6,1 |
| 134 | 20 | MgCl2 | 1,2 | Раствора, содержащего 14,5 г NaCl в 500 г воды; a = 0,8 | Pb(NO3)2; CH3COONa; Na2SO4 | A = 20, B = 0,24 , C = 0,2 , D = 0,61 |
| 135 | 10 | CaCl2 | 1,1 | 20% -го раствора Na2SO4; a = 0,85 | CH3COOK; CuSO4; NaCl | A = 2, B = 0,024 , C = 0,04 , D = 0,366 |
| 136 | 30 | CaCl2 | 1,3 | 30% -го раствора CaCl2; a = 0.9 | ZnCl2; K2SO3; NH4COOH | A = 4, B = 0,096 , C = 0,08 , D = 1,22 |
| 137 | 4 | MgSO4 | 1,06 | Раствора, содержащего 1,36 г Na2SO4 в 500 г воды; a = 0,85 | MgCl2; Na2CO3; NH4Cl | A = 1, B = 0,048 , C = 0,08 , D = 1,22 |
| 138 | 6 | CaCl2 | 1,05 | Раствора, содержащего 71 г Na2SO4 в 250 г воды; a = 0,9 | NH4NO3; K2SO3; Cu(NO3)2 | A = 3, B = 0,036 , C = 0,06 , D = 1,83 |
| 139 | 8 | MgSO4 | 1,08 | 10%- го раствора NaCl; a = 0,8 | K2SiO3; NH4Cl; Na2SO4 | A = 2, B = 0,12 , C = 0,08 , D = 0,976 |
| 140 | 6,3 | Ca(NO3)2 | 1,2 | Раствора, содержащего 2 моля NaCl в 500 г воды; a = 0,9 | ZnCl2; K2CO3; NaCl | A = 5, B = 1,2 , C = 0,4 , D = 1,22 |
| 141 | 2 | CaSO4 | 1,02 | Раствора,содержащего58,5 г NaCl в 1000 г воды; a = 0,9 | CaCl2; Na2SiO3; Mg(NO3)2 | A = 7, B = 0,42 , C = 0,14 , D = 2,562 |
| 142 | 8 | CaCl2 | 1,05 | 40%-го раствора Na2SO4; a = 0,8 | KCN; Fe2(SO4)3; NH4Cl | A = 3, B = 0,48 , C = 0,12 , D = 0,366 |
| 143 | 8 | MgCl2 | 1,05 | Раствора, содержащего 14,2 г Na2SO4 в1000 г воды; a = 0,8 | Pb(NO3)2; BaCl2; FeCl2 | A = 5, B = 0,6 , C = 0,3 , D = 0,61 |
| 144 | 5 | CaCl2 | 1,05 | Раствора, содержащего 33,28 г BaCl2 в 1000 г воды; a = 0,8 | K2CO3; NaCl; Al2(SO4)3 | A = 6, B = 0,216 , C = 0,12 , D = 1,83 |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 145 | 5 | MgCl2 | 1,1 | Раствора, содержащего 58,5 г NaCl в 1000 г воды; a = 0,8 | ZnSO4; AlCl3; KCl | A = 6, B = 0,144 , C = 0,12 , D = 1,83 |
| 146 | 7 | CaCl2 | 1,05 | 30%-го раствора CaCl2; a = 0,9 | (NH4)2SO3; K3PO4; Na2SO4 | A = 7, B = 0,21 , C = 0,14 , D = 2,135 |
| 147 | 20 | CaCl2 | 1,1 | Раствора, содержащего 87,75 г NaCl в 1000 г воды; a = 0,9 | NaCN; Al2(SO4)3; K2SO4 | A = 8, B = 0,096 , C = 0,24 , D = 1,22 |
| 148 | 5,7 | Mg(NO3)2 | 1,04 | Раствора, содержащего 58,5 г NaCl в 1000 г воды; a = 0,8 | NiCl2; K2CO3; BaCl2 | A = 3, B = 0,072 , C = 0,06 , D = 1,83 |
| 149 | 11 | MgSO4 | 1,115 | Раствора, содержащего 29 г NaCl в 500 г воды; a = 0,9 | CH3COONa; Pb(NO3)2; Na2SO3 | A = 5, B = 0.36 , C = 0,3 , D = 0,61 |
| 150 | 15 | Mg(NO3)2 | 1,108 | 10%-го раствора Na2SO4; a = 0,9 | KCN; ZnCl2; K2CO3 | A = 1, B = 0,072 , C = 0,06 , D = 1,83 |
ДИСПЕРСНЫЕ СИСТЕМЫ.
Общая характеристика дисперсных систем.
Дисперсные системы – многофазные гетерогенные системы, в которых одна фаза – непрерывная (дисперсная среда), другие – раздроблены и распределены в первой (эти фазы - дисперсные).
Величина, обратная диаметру (а) частицы дисперсной фазы, называется дисперсностью (или степенью дисперсности): D = 1/а. По степени дисперсности все дисперсные системы разделяются на две группы:
1. грубодисперсные системы, а> 1000 нм;
2. коллоидные системы (золи), а = 1÷1000 нм;
3. истинные растворы, а<1 нм.
Дисперсные системы классифицируются также по агрегатному состоянию дисперсной фазы эмульсии и дисперсионной среды. Так, к аэрозолям (когда дисперсионная среда газообразная) относятся туманы (жидкая дисперсная фаза), дымы и пыли (твёрдая фаза). К лиозолям (с жидкой дисперсионной средой) относятся пены (или газовые эмульсии), обычные эмульсии и суспензии. К твёрдым золям относятся твёрдые пены, твёрдые эмульсии и твёрдые суспензии.
Характерной особенностью дисперсных систем является большая удельная поверхность и, как следствие, - большая поверхностная энергия. Удельная поверхность – это отношение суммарной поверхности частиц к их массе (м 2/г).
Диспесные системы являются термодинамически неустойчивыми. Понижение поверхностной энергии может быть достигнуто за счёт поглощения (адсорбации) поверхность частиц, каких – либо ионов или молекул.
По степени взаимодействия дисперсной фазы с дисперсионной средой коллоидные системы делятся на лиофобные и лиофильные (от греческих слов “лиос” – жидкость, “фобо” - ненавижу, “фило” - люблю). Частицы лиофобных систем практически не взаимодействуют с молекулами дисперсионной среды. В лиофильных системах значительное количество дисперсионной среды связывается дисперсной фазой. Если дисперсионной средой является вода, коллоидные системы называются соответственно гидрофобными и гидрофильными. К гидрофобным золям относятся, например, золи золота, серебра, сернистого мышьяка, йодистого серебра и т. д. К лиофильным золям относятся золи кремниевой кислоты, гидроксида алюминия, а также растворы высокомолекулярных соединений – белков, агара, желатина, крахмала и др.
Методы получения дисперсных систем
Всякое вещество можно получить в дисперсной системе, если создать для этого Необходимые условия. Получить вещество в коллоидном состоянии можно двумя противоположными способами: диспергированием (раздроблением) макрочастиц или конденсацией атомов или молекул. Чтобы получившиеся коллоидные частицы не слипались, необходим стабилизатор в виде ионов, молекул неорганических веществ, поверхностно – активных органических соединений или высокомолекулярных соединений. Последние, адсорбируясь, на поверхности коллоидных частиц, снижают их свободную поверхностную энергию и делают частицу устойчивой.
Для диспергирования можно применять механическое дробление или ультразвуковые колебания. Так, твёрдые и жидкие тела измельчают на коллоидных мельницах, действующих по принципу удара, трения или вибрации.
Если распылять металлы в электрической дуге од водой или в органических жидкостях, то вначале металл испаряется до атомов, а затем происходит конденсация атомов до коллоидных частиц.
Такой метод их получения называется дисперсионно – конденсационным. При конденсационных методах создаются условия для соединения атомов, молекул или ионов в коллоидные частицы. Этого можно достичь охлаждением паров, пересыщением растворов или химическими реакциями получения нерастворимых веществ. Примерами конденсации могут служить образование водного тумана в воздухе или получение золя хлорида натрия при прибавлении спиртового раствора хлористого натрия к эфиру, в котором хлорид натрия не растворяется. К образованию золей приводят следующие реакции:
2H2 S + O 2 = 2S +2H2 O (золь серы)
t0
FeCl3 + 3H2O = Fe(OH)3 + 3HCl (золь гидроксида железа)
Na2SiO3 +2H2O = H2SiO3 +2NaOH (золь кремниевой кислоты)
AgNO3 + KI = AgI + KNO3 ( золь йодида серебра)
Для получения высокодисперсных систем в жидких средах пользуются также методом пептизации. Это один из дисперсионных методов. При пептизации свежеобразованный осадок слипшихся коллоидных частиц под действием стабилизатора снова переходит в коллоидный раствор. Если взять, например, свежеосаждённый и быстро промытый осадок гидроксида железа, прибавить к нему раствор хлорного железа или соляной кислоты, то при перемещении осадок перейдет в раствор, т. е. образуется золь.
Методы очистки коллоидных растворов
Очистить коллоидный раствор от электролитов и органических веществ можно с помощью диализа, электродиализа и ультрафильтрации. При этом используются полупроницаемые мембраны из целлофана, коллодия, пергамента и других материалов. Через поры мембран проходят ионы электролитов и молекулы низкомолекулярных органических веществ, но не могут пройти коллоидные частицы. Низкомолекулярные частицы через мембрану диффундируют в воду. Электродиализ позволяет многократно ускорить очистку золя. При этом золь отделяется от воды мембранами так, чтобы можно было в воде разместить два электрода, к которым подключается постоянное напряжение из расчётов 20...50 В/см.
Ультрафильтрация – это фильтрование коллоидного раствора через полупроницаемую мембрану, укреплённую на твёрдой пористой подкладке в специальной воронке. Процесс ведётся при разряжении снизу или повышением давления сверху. Золь при этом периодически разбавляется водой.
Строение коллоидных частиц (мицелл)
Образование коллоидных частиц рассмотрим на примере реакции образования золя йодистого серебра: AgNO3 + KI = AgI + KNO3. AgI - нерастворимое вещество, поэтому может образовывать золь. Ядро коллоидной частицы образуют микрокристаллики, состоящие из m ионов Ag+ и m ионов I-, т.е. mAgI.
В случае избытка йодистого калия на поверхности ядра будут адсорбироваться ионы I-, которые могли бы увеличить размер ядра и которые имеются в избытке (ионов Ag+ в растворе не остаётся). На ядре адсорбируются n ионов I- и некоторое количество (n – x) катионов K+ из раствора, уменьшающих большой отрицательный заряд ионов йода. Этот слой ионов nI-(n-x)K+ называется адсорбционным. Недостающие для ионной электрической компенсации ионы калия (xK+) могут легко диффундировать от коллоидной частицы в раствор (это диффузный слой). Итак, формула мицеллы: {mAgI×nI-×(n-x)K+}-x×xK+. Устойчивая частица в фигурных скобках – гранула, имеющая в данном случае заряд “-x”. Ионы йода в данном случае обеспечивают отрицательный заряд гранулы и называются, поэтому потенциалопределяющими: ионы калия называются противоионами. Если взять избыток AgNO3, то формула мицеллы будет другой: {mAgI×nAg+×(n-x)NO3-}+x×XNO-3. Здесь гранула имеет положительный заряд. Эти заряды гранул препятствуют слипанию коллоидных частиц, что придаёт золям агрегативную устойчивость.
Процесс слипания дисперсных частиц называется коагуляцией. Золи могут быть скоагулированы добавлением электролитов. Коагулирующее действие оказывает ион противоположного знака по отношению к заряду гранулы. Это действие оказывается тем сильнее, чем выше заряд иона. Тут действует правило Шульце – Гарди: минимальная концентрация электролита, вызывающая коагуляцию золя (так называемый “порог коагуляции “), обратно пропорциональна шестой степени заряда иона, ответственного за коагуляцию, т.е. или катиона, или аниона. Коагулирующие ионы попадают в адсорбционный слой и уменьшают заряд гранулы. Силы отталкивания гранул уменьшаются, и коллоидные частицы начинают слипаться.
Устойчивость золей может быть повышена путём прибавления к ним небольших количеств высокомолекулярных соединений (ВМС). Молекулы ВМС адсорбируются на поверхности коллоидных частиц, образуя гелеобразные плёнки, защищающие частицы от возможного слипания.
При коагуляции некоторые золи способны создавать из коллоидных частиц пространственные сетки, образуя твёрдообразные не текучие структурированные системы, называемые гелями. Некоторые гели (например гели цементных растворов) под влиянием механических воздействий могут переходить в золь (или пластичную, текучую систему), который через некоторое время вновь переходит в гель. Такое явление называется тиксотропией . Гели цементных растворов, кремниевой кислоты и некоторые другие называются хрупкими. Теряя воду, они не уплотняются, т.е подвергаются синерезису. Это явление называется также “старением” геля.
В заданиях по теме “Дисперсные системы” требуется:
1.Составить формулу мицеллы золя (графа С), полученного при взаимодействии вещества (графа А) с избытком вещества (графа В) (см. таблицу ниже). Для этой мицеллы указать потенциалопределяющие ионы, противоионы, заряд гранулы. Для этого указать электролит, наиболее эффективно вызывающий его коагуляцию. Предлагаемые электролиты: KNO3, CaCl2, Al2(SO4)3, Na3PO4. Выбор объяснить.
2.Дать определение, описание и объяснение величинам, явлениям и процессам, приведённым в графе 5.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
| Номер варианта | А | В | С | Величины, явления, процессы |
| 1 | 2 | 3 | 4 | 5 |
| 151 | KI | AgNO3 | AgI | Дисперсная система. Гранула. Суспензия |
| 152 | Na2S | FeCl2 | FeS | Электрокинетический потенциал. Гель. Мицелла. |
| 153 | AlCl3 | NaOH | Al(OH)3 | Степень дисперсности. Агрегативная устойчивость золей. Удельная поверхность |
| 154 | NaBr | AgNO3 | AgBr | Коагулят. Силикагель. Поверхностная энергия. |
| 155 | FeCl3 | NaOH | Fe(OH)3 | Коллоидная система (золь). Кинетическая устойчивость золей. Диффузия. |
| 156 | K2S | MnCl2 | MnS | Электроосмос. Поверхностно – активное вещество. Адсорбация. |
| 157 | Na2SiO3 | HCl | H2SiO3 | Грубодисперсная система. Аэрозоль. Абсорбация. |
| 158 | ZnSO4 | Na2S | ZnS | Защитные коллоиды. Коагуляция. Лиофобные и лиофильные золи. |
| 159 | Ca(NO3)2 | Na2SO4 | CaSO4 | Дисперсная фаза. Правило Шульце – Гарди. Пептизация. |
| 160 | KCl | AgNO3 | AgCl | Активный (активированный) уголь. Порог коагуляции. Диализ. |
| 161 | Cd(NO3)2 | Na2S | CdS | Дисперсная среда. Тиксотропия. Электродиализ |
| 162 | Pb(NO3) | K2S | PbS | Ультрафильтрация. Седиментация. Броуновское движение. |
| 163 | BaCl2 | Na2SO4 | BaSO4 | Эмульсия. Строение коллоидных частиц. Гель. |
| 164 | CuCl2 | Na2S | CuS | Мицелла. Сорбция. Агрегативная устойчивость золей. |
| 165 | SnCl2 | KJ | Sn(OH)2 | Суспензия. Электрофорез. Кинетическая устойчивость золей. |
| 166 | AgNO3 | KI | AgI | Удельная поверхность. Коагулянт. Мицелла. |
| 167 | FeCl2 | Na2S | FeS | Диффузия. Синерезис эластичных гелей. Гранула. |
| 168 | NaOH | AlCl3 | Al(OH)3 | Поверхностная энергия. Дис-персная система. Силикагель. |
| 1 | 2 | 3 | 4 | 5 |
| 169 | AgNO3 | NaBr | AgBr | Адсорбция. Электрокинетический потенциал. |
| 170 | NaOH | FeCl3 | Fe(OH)3 | Адсорбция. Степень дисперсности. Поверхностно – активное вещество. |
| 171 | MnCl2 | K2S | MnS | Лиофильные золи. Коагулянт. Правило Шульце – Гарди. |
| 172 | HCl | Na2SiO3 | H2SiO3 | Лиофобные золи. Коллоидная система (золь). Коагуляция. |
| 173 | Na2S | ZnSO4 | ZnS | Дисперсионные методы получения дисперсных систем. Электроосмос. Сорбция. |
| 174 | Na2SO4 | Ca(NO3)2 | CaSO4 | Конденсационные методы получения дисперсных систем. Защитные коллоиды. Гель. |
| 175 | AgNO3 | KCl | AgCl | Пептизация. Грубодисперсная система. Порог коагуляции. |
| 176 | Na2S | Cd(NO3)2 | CaSO4 | Оптические свойства дисперсных систем. Активный (активированный) уголь. Коагулянт. |
| 177 | K2S | Pb(NO3)2 | PbS | Диализ. Дисперсная фаза. Тиксотропия. |
| 178 | Na2SO4 | BaCl2 | BaSO4 | Электродиализ. Дисперсионная среда. Строение коллоидных частиц. |
| 179 | Na2S | CuCl2 | CuS | Броуновское движение. Ультрафильтрация. Синерезис эластичных гнлей. |
| 180 | NaOH | SnCl2 | Sn(OH)2 | Мицелла. Эмульсия. Электрофорез. |
ВЯЖУЩИЕ СИСТЕМЫ (ЦЕМЕНТЫ)
К вяжущим относятся дисперсные системы, состоящие из избытка твёрдого порошка и жидкости затворения (смешения), которые способны в течение ограниченного времени – минут, часов, суток – самопроизвольно превращаться в прочное камневидное тело – искусственный камень.
Как следует из термодинамического описания химических процессов (разд. 1), самопроизвольно в стандартных условиях происходят процессы, в том числе и камнеобразование, для которых ∆G0298 <0.
Для того чтобы затвердевание системы произошло, необходимо выполнение определённых условий (условий М. М. Сычёва).
1. Химическая реакция между порошком твёрдого и жидкостью должна заканчиваться обязательным образованием комплексного соединения – гидрата, т.е. продукта, содержащего ионы соединения, образующего твёрдый порошок, и молекулы воды.
2.Отношение твёрдого (Т) к жидкости (Ж) должно быть равно или больше критической величины (а): Т/Ж >= а. Такое отношение может достигать двух – трёхкратного значения.
3.Скорость взаимодействия порошка и жидкости не должна быть ни мгновенной, ни слишком большой (техническое условие).
Для того чтобы осуществилось условие 1 – образование гидратов, надо, чтобы между катионом (акцептор А) порошка твёрдого вещества и молекулами воды, являющимися донорами электронных пар (донор Д), была возможность взаимодействия по донорно-акцепторному механизму:
H2O↑↓ + A™ = A ↑↓ OH2
Донор Д Акцептор А Гидрат
Кроме способности катиона и молекул воды образовывать химическую связь, при образовании гидратов следует учитывать отношение размеров катиона и аниона; если отношение приближается к единице, то молекулам воды не хватает физического места в структуре соли, гидрат не образуется и твердение не происходит.
Гидратообразование (комплексообразование) обуславливает возможность проявления дисперсной системой вяжущих свойств в зависимости от положения в таблице Д. И. Менделеева, оно увеличивается в пределах подгруппы снизу вверх, а по периоду – справа налево. В таком же направлении изменяется вяжущая способность системы в зависимости от катиона соли. Количественной оценкой вяжущей способности системы является показатель прочности при сжатии (под прочностью понимается сопротивление системы разрушению).
Выделим две классификации вяжущих – по положению в таблице Д. И. Менделеева и по эксплуатационным свойствам.
По первой классификации в соответствии с принадлежностью к семейству катиона – акцептора, обеспечивающего твердение, вяжущие системы (цементы) можно разделить на s- , p-, d- цементы. Например, кристаллогидрат CaSO4∙2H2O обеспечивает получение s-цемента, т. к. кальций – s-элемент; Zn3(PO4)2∙4H2O лежит в основе получения d-цемента; т. к. цинк - d-элемент; Al2(SO4)3 ∙18H2 O – p-цемент, т. к. Al – p-элемент.
Классификация по положению в таблице Д. И. Менделеева позволяет, во – первых, прогнозировать проявление вяжущего свойства как свойства электронных аналогов s-, p- и d- элементов; во-вторых, химическая классификация позволяет прогнозировать прочность химической связи в гидратах, а следовательно, и прочность вяжущих систем на их основе в направлении роста энергии орбиталей – акцепторов d > p > s при прочих равных условиях – степени дисперсности, величине Т/Ж, температуре, давлении. В- третьих, она позволяет предвидеть клеящую способность системы, или иначе, адгезионные свойства, например, p- и d-цементы должны обладать более высокой клеящей способностью (адгезией), чем s-цементы, т.к. энергия p- и d-орбиталей выше, чем энергия s-орбиталей.
Четвёртая особенность этой классификации состоит в том, что она позволяет прогнозировать механические свойства полученных искусственных камней. Более гибкие, гантелевидное направленности в пространстве, например р–орбитали, характерные для р-цементов, будут способствовать более “гибкой” структуре материала – искусственного камня, т.е.более высокой прочности при изгибе.
Вторая классификация вяжущих систем на растворимости гидратов в воде и на соответствующей растворимости искусственных каменных материалов. Можно выделить две группы вяжущих: воздушные, кристаллогидраты которых и, следовательно, искусственные камни растворимы в воде, и гидравлические, кристаллогидраты которых и, следовательно, затвердевший материал на их основе в воде не растворимы. К воздушных вяжущих относятся сульфатные, хлоридные, нитратные s-, p- и d-цементы, а также силикатные и алюминатные ns1-цементы (1 главная подгруппа), к гидравлическим - силикатные, алюминатные и фосфатные s-, p- и d-цементы. Наибольшее применение в строительной практике из воздушных вяжущих имеют гипсовые, магнезиальные и гашёная известь, гидратация и твердение которых протекает по реакциям, осуществляющимся в системе из избытка порошка (Т) и недостатка жидкости затвердения (Ж) (Т/Ж~2÷3) и приводящим, поэтому к возникновению камня.
При гидратации и твердении гипсовых вяжущих исходная система состоит из порошка CaSO4×0,5H2O (полуводный гипс) и воды, отношение количества воды к порошку ~ 0,3… 0,5, т.е. воды, примерно в 2...3 раза меньше. Эта система затвердевает в камень благодаря самопроизвольной экзотермической реакции перехода полуводного гипса в двуводный:

 CaSO4∙0,5H2O + 1,5H2O = CaSO4∙2H2O, ∆H < 0
CaSO4∙0,5H2O + 1,5H2O = CaSO4∙2H2O, ∆H < 0
 порошок
порошок
Исходная паста → Гипсовый камень
Уже через один-два часа гипсовая система имеет прочность при сжатии порядка (35...55)∙105 Па.
Гипсовая вяжущая система – s-цемент, т.к. кальций s-элемент. Из электронных аналогов подобных свойством обладают сульфаты бериллия и магния, а сульфаты стронция и бприя не образуют гидратов и искусственного камня вследствие особенностей их геометрического строения, т.е., как уже отмечалось, вяжущая способность уменьшается при движении по подгруппе сверху вниз.
Кроме s-элементов, искусственные камни образуются из сульфатов на основе p-элементов, например гидратов сульфата алюминия, и d-элементов, например гидратов сульфатов железа, никеля, кобальта, цинка, меди.
Сульфаты можно заменить на хлориды. Хлоридные вяжущие системы образуют кальций и его электронные аналоги - магний, стронций, барий, а также p-элементы, например алюминий и d-элементы, например никель, кобальт.
Если взять порошок оксида магния MgO (каустический магнезит) и смешать (затворить) с раствором соли хлорида магния MgCl2, то камень формируется (при условии избытка порошка твёрдого – оксида магния) благодаря самопроизвольной экзотермической реакции образования комплексного гидроксохлорида магния:
5MgO + MgCl2 + 12H2O = MgCl2∙5Mg(OH)2∙7H2O, ∆H<0
порошок

 Исходная паста Магнезиальный камень
Исходная паста Магнезиальный камень
Прочность магнезиального камня выше, чем гипсового. Магнезиальная вяжущая система также является s-цементом; электронные аналоги магния дают подобные вяжущие свойства по группе сверху вниз – это значит, что прочность при прочих равных условиях в пределах группы падает.
Известковая вяжущая система состоит из порошка оксида кальция (негашёная известь) и воды; взаимодействие происходит по следующей экзотермической реакции (гашение извести).
CaO + H2O = CaO∙H2O, ∆H<0
Порошок
Со временем в присутствии углекислоты воздуха происходит карбонизация гидроксида кальция по реакции Ca(OH)2 + CO2 = CaCO3 + H2O. Прочность материала при этом увеличивается.
Наибольшее применение в качестве гидравлического вяжущего находят порошки силикатов и алюминатов кальция, которые либо специально получены на цементных заводах, либо составляют побочные продукты производства (отходы). На цементных заводах России и большинства других стран чаще всего получают портландцемент – порошок, состоящий из искусственно полученных силикатов и алюминатов кальция, а также алюмоферрата кальция, соли более сложного состава, и гипса. При соблюдении условий Сычёва система из этого порошка и воды способна превращаться в прочное камневидное тело, устойчиво существующее и на воздухе, и в воде.
В табл. 1 представлен примерный процентный состав веществ (минералов), из которых состоит портландцементный порошок, их названия, формулы написания и уравнения химических реакций, лежащих в основе возникающей прочности системы. Приведённые в табл. 1 реакции, обеспечивающие в последующем прочность до 1000∙105 Па, - это реакции гидратации, т.е. присоединения молекул воды к безводным исходным солям. Подобно тому, как в процессах электрохимии происходит превращение энергии химических реакций в электрический ток, в вяжущих системах происходит превращение части энергии химической реакции гидратации в механическую прочность полученного искусственного камня, одной из оценок которой является прочность затвердевшей системы при сжатии.
Реакции гидратации (камнеобразования) (табл.1) идут самопроизвольно с понижением внутренней энергии системы в целом. Кроме того, эти реакции продолжаются годами, т.е. на самом деле искусственные камни “живые”.
Системы из силикатов и алюминатов аналогов кальция в соответствующих условиях также проявляют вяжущие свойства, закономерно убывающие при движении в пределах подгруппы сверху вниз.
К гидравлическим вяжущим относятся и фосфатные системы, например цинкофосфатная, которая состоит из порошка оксида цинка и жидкости затворения H3PO4, затвердевающих в камень при выполнении условий Сычёва:
3ZnO + 2H3PO4 + H2O = Zn3(PO4 Обсуждений еще не было, будьте первым... ↓↓↓
![]() 2020-02-04
2020-02-04![]() 211
211![]() Обсуждений (0)
Обсуждений (0)
Обсуждение в статье: Способы устранения жесткости.

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

