 |
Главная |
Произведение растворимости
|
из
5.00
|
Как упоминалось выше, растворимость веществ в воде различна. Однако абсолютно нерастворимых веществ в природе не существует. Любое вещество, хотя бы в ничтожной степени, обладает растворимостью. Рассмотрим равновесие между твердым осадком трудно растворимой соли AgCl и ее ионами в водном растворе:
AgClтвó Ag+ + Cl-
Константа равновесия имеет вид:
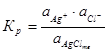 1.30
1.30
Активность твердой фазы величина постоянная и выражение 1.30 преобразуют к виду, называемому произведением растворимости (ПР):
ПРAgCl = 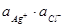 1.31.
1.31.
В общем случае для трудно растворимого электролита ApBq произведение растворимости имеет вид:
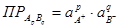 1.32.
1.32.
Произведение растворимости, как и растворимость, зависит от температуры.
Хотя ПР при данной температуре величина постоянная, растворимость вещества может меняться в зависимости от ряда условий:
1. присутствие в растворе электролита, не имеющего общих ионов с осадком. В этом случае растворимость увеличивается из-за изменения коэффициентов активности в сторону понижения.
2. присутствие в растворе электролита, имеющего общий ион с осадком. В этом случае растворимость, как правило, резко уменьшается.
3. присутствие в растворе вещества, способного образовывать комплексные соединения с ионами трудно растворимого вещества. В этом случае растворимость, как правило, резко возрастает.
Пример 12. Определите растворимость PbCl2 в его насыщенном растворе и в растворе 0,1 m NaCl. 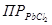 =1.6*10-5 .
=1.6*10-5 .
РЕШЕНИЕ. Обозначим растворимость, выраженную в моляльностях, через x, тогда для насыщенного раствора 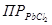 =x*(2x)2 = 4x3, так как PbCl2 ó Pb2+ + 2Cl-. Отсюда
=x*(2x)2 = 4x3, так как PbCl2 ó Pb2+ + 2Cl-. Отсюда 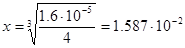 ≈ 0.016 m. В случае раствора NaCl
≈ 0.016 m. В случае раствора NaCl 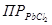 будет иметь вид:
будет иметь вид: 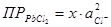 , причем активность ионов хлора определяется NaCl и она равна (см.табл.2) 0,786*0,1=0,0786. тогда
, причем активность ионов хлора определяется NaCl и она равна (см.табл.2) 0,786*0,1=0,0786. тогда 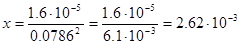 m.
m.
Гидролиз.
Любую соль можно, в принципе, получить по реакции нейтрализации, взяв соответствующие основание и кислоту. При этом катион соли может быть остатком как сильного, так и слабого электролита. То же самое относится и к аниону соли. Таким образом, соль может быть образована:
1. сильным основанием и сильной кислотой, например NaCl
2. сильным основанием и слабой кислотой, например Na2CO3
3. слабым основанием и сильной кислотой, например AlCl3
4. слабым основанием и слабой кислотой, например (NH4)2CO3.
При растворении солей в воде в последних трех случаях происходит процесс, получивший название гидролиз соли. Определение этого процесса будет приведено ниже.
Рассмотрим процессы, протекающие при растворении соли, образованной сильным основанием и слабой кислотой (Na2CO3).
Вначале соль, как сильный электролит, полностью распадется на ионы:
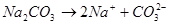 1.33.
1.33.
Одновременно происходит диссоциация воды:
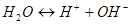 1.34.
1.34.
Поскольку угольная кислота слабый электролит, то ее остаток (ион 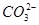 ) стремится вернуться в недиссоциорованную форму, захватывая ион водорода, что усиливает диссоциацию воды. При этом происходит подщелачивание среды (рН>7).
) стремится вернуться в недиссоциорованную форму, захватывая ион водорода, что усиливает диссоциацию воды. При этом происходит подщелачивание среды (рН>7).
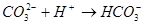 1.35.
1.35.
Сумма 1.33 – 1.35 дает уравнение гидролиза соли:
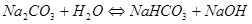 1.36
1.36
или в сокращенной ионной форме:
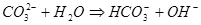 1.37.
1.37.
Это 1-ая стадия гидролиза карбоната натрия. По второй стадии, представленной уравнениями:
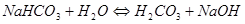 1.38
1.38
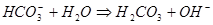 1.39
1.39
процесс практически не идет, так как накопившийся избыток ионов гидроксила запускает реакцию 1.37 в обратном направлении.
Аналогично происходит процесс растворения соли, образованной слабым основанием и сильной кислотой. Только в этом случае происходит связывание ионов гидроксила катионом, являющимся остатком слабого основания. Среда в этом случае подкисляется (рН<7). Например, для AlCl3 имеем:
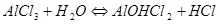 1.40
1.40
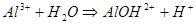 1.41.
1.41.
Для этой соли возможно протекание гидролиза по второй стадии:
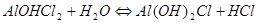 1.42
1.42
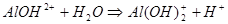 1.43.
1.43.
И по третьей:
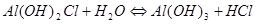 1.44
1.44
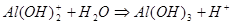 1.45
1.45
Однако гидролиз по второй, а тем более по третьей стадии не протекает из-за протекания реакции 1.41 в обратном направлении при накоплении избытка ионов водорода в растворе.
Для соли, образованной слабым основанием и слабой кислотой все происходит немного иначе из-за того, что в растворе присутствуют как остаток слабого основания, так и остаток слабой кислоты. В этом случае происходит одновременной связывание как ионов водорода, так и ионов гидроксила, что приводит к полному нарушению ионного равновесия воды. рН среды близок к 7. например, для (NH4)2CO3 имеем:
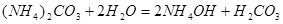 1.46
1.46
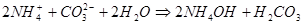 1.47.
1.47.
Это пример так называемого полного гидролиза. Полный гидролиз можно осуществить, если к раствору соли, образованной слабым основанием и сильной кислотой, добавить эквивалентное количество раствора соли, образованной сильным основанием и слабой кислотой. Например:
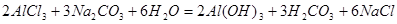 1.48
1.48
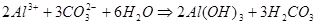 1.49.
1.49.
Теперь приведем определение гидролиза.
|
из
5.00
|
Обсуждение в статье: Произведение растворимости |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

