 |
Главная |
Осмотический закон Вант-Гоффа.
|
из
5.00
|
Вант-Гофф показал, что для разбавленных растворов независимо от природы растворителя и растворенного вещества математическое выражение для осмотического давления имеет вид:
Росм = CRT 1.4
где: Росм – осмотическое давление, С – молярная концентрация раствора, Т – абсолютная температура, R – универсальная газовая постоянная. При этом, если концентрация имеет размерность М/л, то осмотическое давление получается в КПа.
Осмотический закон Вант-Гофф сформулировал так:
Осмотическое давление разбавленных идеальных растворов численно равно тому давлению, которое оказывало бы растворенное вещества, если бы при данной температуре оно занимало объем раствора и находилось в газообразном состоянии. Схема осмоса приведена на рис.1.
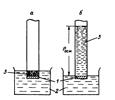
Рис.1 Схема осмоса через полупроницаемую мембрану. 1 – полупроницаемая мембрана, 2 – растворитель, 3 – раствор. а – начальное состояние системы, б – конечное.
Закон Генри .
Этот закон определяет растворимость летучих веществ (газов) и формулируется: при данной температуре концентрация растворенного газа пропорциональна его парциальному давлению. Математическое выражение этого закона имеет вид:
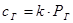 1.5
1.5
где: СГ – концентрация газа в растворе, РГ его парциальное давление, к – константа Генри, зависящая от природы растворителя и газа.
Следствия из закона Генри:
1. Объем растворенного газа не зависит от давления. Действительно, пусть в каком-то объеме растворителя (Vр-тель) при температуре Т и давлении Р растворилось n молей газа. Объем растворившегося газа VГ равен 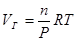 . Из закона Генри следует, что
. Из закона Генри следует, что 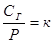 , но
, но 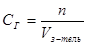 , откуда
, откуда 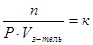 и
и 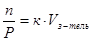 . При постоянной температуре Vз-тель =const, а значит n/P=const и VГ =const·RT не зависит от давления. Поэтому растворимость газа в жидкостях характеризуют отношением объема газа к объему растворителя – обычно числом миллилитров газа, растворяющихся в 1 л растворителя.
. При постоянной температуре Vз-тель =const, а значит n/P=const и VГ =const·RT не зависит от давления. Поэтому растворимость газа в жидкостях характеризуют отношением объема газа к объему растворителя – обычно числом миллилитров газа, растворяющихся в 1 л растворителя.
2. при растворении смеси газов растворимость каждого из них пропорциональна его парциальному давлению в газовой фазе.
Эти следствия справедливы лишь для разбавленных растворов, а также, если газ или смесь газов находятся при сравнительно низком давлении и подчиняется законам идеального газа.
Й закон Рауля.
Общим для всех жидких растворов свойством является понижение давления насыщенного пара компонентов по сравнению с соответствующими характеристиками чистых веществ. Количественно связь между концентрацией летучего вещества в идеальном растворе и давлением его пара над раствором выражается законом Рауля:
При постоянной температуре давление насыщенного пара компонента идеального раствора пропорционально его мольной доле в растворе.
Математическое выражение этого закона имеет вид:
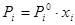 1.6
1.6
где: Pi – парциальное давление летучего компонента над раствором, 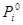 - давление насыщенного пара чистого компонента,
- давление насыщенного пара чистого компонента, 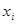 - мольная доля компонента.
- мольная доля компонента.
В случае, когда растворяется нелетучее вещество, то математическое выражение закона Рауля можно представить в виде:
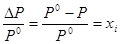 1.7
1.7
где: Р0 и Р – давление пара растворителя над чистым растворителем и раствором, соответственно; 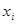 - мольная доля растворенного вещества (см. рис.2).
- мольная доля растворенного вещества (см. рис.2).
|
из
5.00
|
Обсуждение в статье: Осмотический закон Вант-Гоффа. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

