 |
Главная |
Закон разбавления Оствальда.
|
из
5.00
|
Диссоциация сильных электролитов в водных растворах протекает нацело. Остальные электролиты диссоциируют обратимо и, следовательно, к их процессу диссоциации может быть применен закон действия масс. Так, например, для процесса диссоциации уксусной кислоты
CH3COOH ó CH3COO- + H+
константа равновесия, которую для процессов диссоциации называют константой диссоциации КД, будет равна:
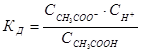 1.15
1.15
Константа диссоциации зависит от природы растворителя и электролита, а также от температуры, и не зависит от концентрации раствора.
Поскольку степень диссоциации электролита зависит от его концентрации, выясним эту зависимость. Для этого рассмотрим процесс диссоциации уксусной кислоты. Допустим, имеется раствор уксусной кислоты, концентрация которого равна С, а степень электролитической диссоциации – α. Тогда число продиссоциированных молекул уксусной кислоты будет равно α·С, а концентрации аниона и катиона одинаковы и равны α·С. равновесная концентрация нераспавшихся молекул уксусной кислоты будет равна (1-α)С. Подставив эти величины в выражение для константы диссоциации, получим:
 1.16
1.16
Это уравнение известно как закон разбавления Оствальда.
Для слабых электролитов α«1 и (1-α)≈1. Тогда
КД≈α2С и  1.17
1.17
Следовательно, для любого электролита можно задать такую концентрацию, когда степень электролитической диссоциации будет больше 0,3 (30%). Поэтому электролиты по силе сравнивают при одинаковой концентрации, чаще всего при 0,1Н.
Для более сложных электролитов таких, как, например, Н3РО4 процесс диссоциации протекает по стадиям (ступенчато):
1-ая стадия (ступень)

 .
.
Если 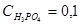 m, то, как можно рассчитать, используя закон разбавления Оствальда и значение КД, α≈0,1 (10%).
m, то, как можно рассчитать, используя закон разбавления Оствальда и значение КД, α≈0,1 (10%).
2-ая стадия (ступень)

 .
.
Допустим, что существует соединение  , тогда при его концентрации 0,1 m α≈0,002 (0,2%).
, тогда при его концентрации 0,1 m α≈0,002 (0,2%).
3-ая стадия (ступень)

 .
.
Как правило, для такого рода электролитов отношение значений предыдущей константы диссоциации к последующей (  ) равно примерно 105.
) равно примерно 105.
Сильные электролиты.
Как уже упоминалось выше, сильные электролиты в растворе диссоциируют нацело, что приводит к высокой концентрации ионов в растворе. Поэтому свойства таких растворов будут существенно зависеть от степени взаимодействия входящих в их состав ионов как друг с другом, так и с полярными молекулами растворителя. Из-за взаимного притяжения разноименных и отталкивания одноименно заряженных ионов каждый произвольно выбранный ион будет окружен в среднем по времени противоположно заряженными ионами, как в ионных кристаллах. Однако, из-за энергии теплового движения ионов, которая в растворах значительно выше, чем в кристаллах, ионы, взаимодействующие с выбранным центральным ионом, располагаются в виде сферы, которая называется ионная атмосфера. Ионные атмосферы обладают следующими особенностями:
1 - в их состав входят как катионы, так и анионы, с преобладанием ионов противоположных по знаку центральному.
2 - суммарный заряд ионной атмосферы равен заряду центрального иона и противоположен по знаку.
3 - все ионы в растворе равноправны, поэтому каждый из них является центральным и одновременно входит в состав ионной атмосферы другого иона.
4 - за счет теплового движения ионы, входящие в состав ионной атмосферы, постоянно меняются местами с ионами, находящимися за ее пределами, т.е. ионная атмосфера носит статистический характер.
С увеличением концентрации электролита радиус ионной атмосферы уменьшается, что приводит к возрастанию вероятности существования ионных пар, так называемых ионных двойников и тройников, отличие которых от молекул заключается в большей длине связи и наличия взаимодействующих с ионной парой молекул растворителя. Одновременно меняется и сольватация.
Таким образом, с увеличением концентрации приводит к возрастанию близкодействующих сил химической связи. Поэтому с ростом концентрации увеличивается различие в свойствах растворов электролитов одинаковой концентрации, но разного химического состава и, следовательно, законы идеальных растворов для растворов электролитов оказываются неприменимыми.
Чтобы можно было пользоваться законами для идеальных растворов в случае растворов электролитов, Льюис в 1907 г. ввел представление об эффективной концентрации, которую он назвал активностью. Активность (а) связана с концентрацией простым соотношением:
a = γC 1.18
где γ – коэффициент активности, С – концентрация.
Коэффициент активности учитывает все виды взаимодействия частиц в растворе, приводящие к отклонению его свойств от свойств идеального раствора. Так как коэффициент активности учитывает также степень диссоциации электролита, то их применяют и при описании свойств растворов слабых электролитов.
Если в уравнения, отражающие законы Рауля, Вант-Гоффа и др., вставить активность вместо концентрации, то эти уравнения остаются справедливыми и для растворов электролитов любой силы.
Коэффициенты активности вычисляют по экспериментальным данным. Для этого измеряют какое-либо из свойств раствора, например температуру кипения, и определяют коэффициент активности как частное от деления экспериментальной величины на теоретически рассчитанную по законам идеальных растворов:
 1.19
1.19
где: γ – коэффициент активности, 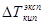 - экспериментальная величина,
- экспериментальная величина,  - теоретическая величина.
- теоретическая величина.
Приведенный метод позволяет определить лишь значения средних коэффициентов активности электролита. В настоящее время не существует методов, позволяющих определять коэффициенты активности отдельных ионов. При необходимости расчета этих величин принимают, что средний коэффициент активности электролита представляет собой среднее геометрическое коэффициентов активности образующих его ионов. Так для электролита AnBm
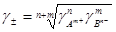 1.20
1.20
Коэффициенты активности зависят от природы растворителя и растворенного вещества, от концентрации раствора и температуры. В таблице 1 приведены экспериментальные средние коэффициенты активности некоторых электролитов.
Табл.1. Средние коэффициенты активности электролитов при 298˚К.
| m |
| |||||
| (М/кг) | NaCl | NaOH | KOH | HCl | H2SO4 | CaCl2 |
| 0,001 | 0,966 | 0,966 | 0,966 | 0,966 | 0,830 | 0,840 |
| 0,01 | 0,904 | 0,900 | 0,900 | 0,904 | 0,544 | 0,580 |
| 0,1 | 0,778 | 0,776 | 0,800 | 0,796 | 0,265 | 0,518 |
| 0,5 | 0,681 | 0,693 | 0,730 | 0,758 | 0,154 | 0,448 |
| 1,0 | 0,657 | 0,679 | 0,760 | 0,809 | 0,132 | 0,500 |
| 2,0 | 0,668 | 0,700 | 0,890 | 1,010 | 0,128 | 0,792 |
| 5,0 | 0,874 | 1,060 | 1,670 | 2,380 | 0,208 | 5,89 |
| 10,0 | - | 3,180 | 6,050 | - | 0,559 | 43,0 |
Как видно из табл.1, коэффициенты активности по мере разбавления раствора стремятся к единице, а с ростом концентрации могут достигать больших величин.
В разбавленных растворах при концентрации меньше 0,1 m коэффициенты активности зависят в основном от заряда иона и концентрации и мало зависят от природы электролита. Эта закономерность известна в теории растворов как правило ионной силы. Согласно этому правилу ионы одинаковой зарядности при одной и той же ионной силе имеют одинаковые коэффициенты активности.
Ионной силой раствора называется полусумма произведений концентраций всех ионов раствора на квадрат их заряда:
 1.21
1.21
где: I – ионная сила, Ci – концентрация иона, zi – заряд иона.
Правило ионной силы позволяет рассчитать коэффициенты активности отдельных ионов в разбавленных растворах. Коэффициенты активности ионов уменьшаются с увеличением ионной силы раствора и заряда иона (Табл.2).
Табл.2. коэффициенты активности ионов в водных растворах при 298˚К.
| ионы | Коэффициенты активности для ионной силы | |||||
| 0,001 | 0,005 | 0,01 | 0,02 | 0,05 | 0,1 | |
| Однозарядные | 0,966 | 0,927 | 0,902 | 0,872 | 0,826 | 0,786 |
| Двухзарядные | 0,843 | 0,693 | 0,605 | 0,505 | 0,369 | 0,278 |
| Трехзарядные | 0,798 | 0,638 | 0,544 | 0,439 | 0,297 | 0,203 |
Если вместо концентраций пользоваться активностями ионов, то и константа диссоциации для сильных электролитов имеет смысл. Так, например, для диссоциации серной кислоты:
1-ая стадия

 .
.
2-ая стадия

 .
.
В дальнейшем коэффициенты активности и , соответственно, активность будут применяться только в самых необходимых случаях, поскольку коэффициенты активности однозарядных ионов в разбавленных растворах не сильно отличаются от единицы.
|
из
5.00
|
Обсуждение в статье: Закон разбавления Оствальда. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы


 для электролитов
для электролитов