 |
Главная |
Степень гидролиза есть отношение числа молей соли, подвергшихся гидролизу к исходному числу молей соли в растворе.
|
из
5.00
|
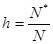 1.50
1.50
где N* - число молекул, подвергшихся гидролизу; N – исходное число молекул соли.
Для карбоната натрия (1.37) константа равновесия имеет вид:
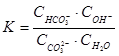 1.51
1.51
Учитывая постоянство активности воды, 1.51 преобразуется к виду:
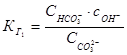 1.52.
1.52.
Это есть выражение для константы гидролиза карбоната натрия. Если его умножить и разделить на 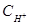 , то получим:
, то получим:
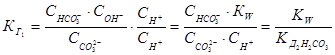 1.53.
1.53.
Таким образом, можно утверждать, что константа гидролиза по первой стадии связана с константой диссоциации слабого электролита по последней стадии. Однако, как можно показать, для соли, образованной слабым основанием и слабой кислотой, эта взаимосвязь имеет вид:
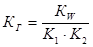 1.54
1.54
где: KW –ионное произведение воды, К1 и К2 – константы диссоциации слабого основания и слабой кислоты, соответственно.
Связь степени гидролиза и константы гидролиза, как легко показать, имеет вид аналогичный закону разбавления Оствальда:
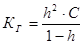 1.55.
1.55.
При h«1 КГ ≈ h2∙C, и h ≈ √КГ/С. 1.56
Таким образом, при разбавлении раствора гидролиз усиливается. Если надо подавить гидролиз, то нужно или концентрировать раствор, или добавить соответствующий сильный электролит: кислоту для соли, образованной слабым основанием и сильной кислотой, и щелочь для соли, образованной сильным основанием и слабой кислотой.
С повышением температуры гидролиз усиливается за счет, в основном, усиления диссоциации воды.
Пример 13. Напишите уравнения реакции гидролиза Cr(NO3)3. определите реакцию среды (по значению рН), напишите выражение для константы гидролиза и определите направление смещения равновесия при: разбавлении, добавление в систему ионов водорода, добавление в систему гидроксид-ионов, нагревании.
РЕШЕНИЕ. Соль образована слабым основанием (Cr(OH)3 нерастворим) и сильной кислотой. Следовательно, гидролиз будет происходить по катиону и в ионном и молекулярном виде уравнения имеют вид:
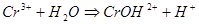 .
.
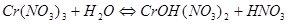 .
.
Выражение для константы гидролиза имеет вид:
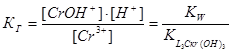
Поскольку при гидролизе образуется избыток ионов водорода, то реакция среды будет кислая (рН<7). Равновесие сместится вправо при разбавлении, нагревании и добавлении в систему ионов гидроксила. При добавлении в систему ионов водорода равновесие сместится влево.
Пример 14. Определите значение рН 0,1 m раствора Na2CO3 .
РЕШЕНИЕ. Соль образована сильным основанием и слабой кислотой. Следовательно, гидролиз будет происходить по аниону, реакция среды будет щелочная (рН>7), и в ионном и молекулярном виде уравнения имеют вид:
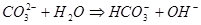
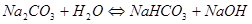
Определим значение константы гидролиза по выражению 1.53:
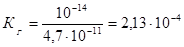 .
.
Далее определим степень гидролиза, воспользовавшись выражениями 1.55 и 1.56:
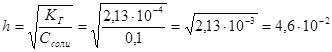 . Тогда концентрация ионов гидроксила будет равна h·C = 4.6·10-3, а концентрация ионов водорода будет равна (см. выражение 1.25) 2,17·10-12 и рН = 11,66.
. Тогда концентрация ионов гидроксила будет равна h·C = 4.6·10-3, а концентрация ионов водорода будет равна (см. выражение 1.25) 2,17·10-12 и рН = 11,66.
Амфотерность
Амфотерными называются электролиты, дающие при диссоциации в воде в зависимости от условий ионы водорода (Н+) или гидроксила (ОН-).
Примерами амфотерных электролитов могут служить как растворимые в воде (аминокислоты), так и нерастворимые (гидраты окислов некоторых элементов).
Для аминокислот и некоторых других органических электролитов причиной амфотерности является наличие, по крайней мере, двух различных функциональных групп, одна из которых проявляет кислотные свойства, а другая - основные.
Для гидратов окислов причина амфотерности другая. В их составе всегда можно выделить группировку:
Э-О-Н, 1.57
где Э – элемент, О - кислород, Н – водород.
В зависимости от соотношения энергий связи О-Н и О-Э, могут реализоваться три варианта:
1. энергия связи О –Н прочнее, чем для связи Э – О
2. энергия связи О –Н примерно такая же как и для связи Э –О
3. энергия связи О –Н слабее, чем для связи Э –О
В первом случае гидрат окисла является основанием, в третьем – кислотой, а во втором проявляет амфотерные свойства.
В начале любого периода всегда реализуется первый вариант, и все гидраты окислов являются типичными основаниями. В конце любого периода реализуется третий вариант, и все гидраты окислов являются типичными кислотами. Где-то ближе к середине периода ( в разных периодах это происходит по разному) реализуется второй вариант.
Для второго периода это происходит уже у Ве, в третьем – у Al, в четвертом – у Zn, Ga и Ge, в пятом у In и Sn, в шестом у Pb.
Однако существует и другая возможность, реализующаяся у переходных элементов. Для тех из них, которые могут реализовать несколько валентных состояний, в низших валентных состояниях реализуется первый вариант, а в высших, когда валентность элемента 5 и выше, реализуется третий вариант. В средних же валентных состояниях они проявляют амфотерные свойства. В первой вставной декаде амфотерные свойства проявляют Ti и V, в четырех валентном состоянии, Cr, в трех валентном состоянии, Mn, в четырех валентном состоянии. У элементов второй и третьей вставных декадах явного проявления амфотерных свойств не обнаружено.
Соответственно этому амфотерные гидроксиды в кислой среде выступают в качестве оснований, а в щелочной – кислот. Однако взаимодействие амфотерного гидроксида со щелочью дает разные продукты в зависимости от того, проводится ли реакция в растворе или путем сплавления (в твердом виде). Формы получающихся продуктов (анионы) приведены в таблице 4 в общем виде.
Табл. 4.
Формы анионов амфотерных гидроксидов при взаимодействии со щелочами.
| Валентное | Форма существования аниона: | |
| состояние элемента | в растворе | в твердом виде |
| Э(II) | 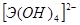
| 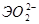
|
| Э(III) | 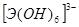
| 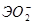
|
| Э(IV) | 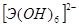
| 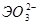 мета, мета, 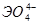 орто орто
|
Пример 15. Напишите уравнения реакций взаимодействия Al(OH)3 с растворами H2SO4 и NaOH в молекулярной и ионной форме.
РЕШЕНИЕ. Уравнения взаимодействия с серной кислотой имеют вид:
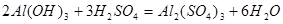
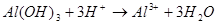
Взаимодействие с NaOH протекает так:
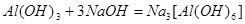
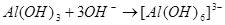
|
из
5.00
|
Обсуждение в статье: Степень гидролиза есть отношение числа молей соли, подвергшихся гидролизу к исходному числу молей соли в растворе. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

