 |
Главная |
Ой и 3-ий законы Рауля
|
из
5.00
|
Понижение давления пара растворителя над раствором приводит к изменениям температур кипения и кристаллизации растворов. Отметим, что любая жидкость кипит тогда и только тогда, когда давление ее паров равняется внешнему. Любая жидкость кристаллизуется тогда и только тогда, когда давление ее паров равно давлению над твердой фазой.
Рассмотрим эти изменения на примере системы, состоящей из нелетучего растворенного вещества и растворителя, в которой не происходит образования твердых растворов при кристаллизации. Например, раствор сахара или NaCl в воде.
Вид диаграммы состояния такого рода систем в координатах Р, Т приведен на рис.2. на этой диаграмме различия между линиями 2 и 4, 3 и 5 утрированно велики.
Вблизи тройной точки (А на рис.2) диаграмма состояния любой системы, приведенная на рис.2, представляется тремя пересекающимися линиями: 1 – линия равновесия твердое – газ, 2 – линия равновесия жидкость – газ, 3 – линия
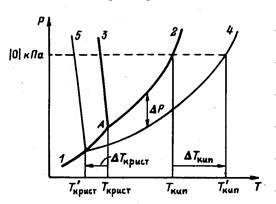
Рис.2 Р-Т диаграммы для растворителя и раствора.
равновесия жидкость – твердое. На этом же рисунке приведены линии соответствующих равновесий для раствора: 4 – линия равновесия жидкость – газ, 5 – линия равновесия жидкость – твердое. Поскольку в системе отсутствуют твердые растворы, то линия равновесия твердое – газ для раствор совпадает с таковой для чистого растворителя. Так как 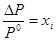 и не зависит от температуры, то при увеличении Р0 увеличивается и ΔР, поэтому линии 2 и 4 с ростом температуры расходятся.
и не зависит от температуры, то при увеличении Р0 увеличивается и ΔР, поэтому линии 2 и 4 с ростом температуры расходятся.
Линия 4 пересекает линию 1 при такой температуре, которая обязательно лежит ниже тройной точки А, следовательно, температура кристаллизации растворителя из раствора (линия 5) всегда ниже, чем для чистого растворителя.
При повышении температуры давление пара растворителя над раствором растет и, когда оно достигнет внешнего давления, раствор кипит. Поскольку давление пара растворителя над раствором всегда ниже, чем для чистого растворителя, то равенство давлений пара и внешнего будет достигнуто при более высокой, чем для чистого растворителя, температуре. Следовательно, температура кипения раствора всегда выше, чем для чистого растворителя.
2-й закон Рауля рассматривает из изменения температуры кипения раствора относительно чистого растворителя, математическое выражение его имеет вид:
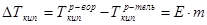 1.8
1.8
где: 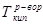 ,
, 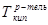 - температуры кипения раствора и растворителя, соответственно, Е – эбулиоскопическая постоянная (для воды Е=0,52), m – моляльная концентрация раствора.
- температуры кипения раствора и растворителя, соответственно, Е – эбулиоскопическая постоянная (для воды Е=0,52), m – моляльная концентрация раствора.
3-й закон Рауля рассматривает изменения температуры кристаллизации раствора относительно чистого растворителя, математическое выражение его имеет вид:
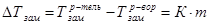 1.9
1.9
где 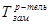 ,
, 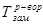 - температуры замерзания (кристаллизации) растворителя и раствора, соответственно, К – криоскопическая постоянная (для воды К=1,86), m – моляльная концентрация раствора.
- температуры замерзания (кристаллизации) растворителя и раствора, соответственно, К – криоскопическая постоянная (для воды К=1,86), m – моляльная концентрация раствора.
2-й и 3-й законы Рауля можно сформулировать совместно:
Повышение (понижение) температуры кипения (кристаллизации) раствора относительно чистого растворителя пропорциональны его моляльной концентрации.
Следствия из 2-го и 3-го законов Рауля:
1. раствор любого твердого (нелетучего) вещества, в отличие от чистого растворителя, не имеет постоянной температуры кипения. Действительно, при кипении такого раствора испаряется растворитель, что влечет за собой увеличение концентрации раствора. Последнее приводит к увеличению температуры кипения.
2. раствор любого твердого (нелетучего) вещества, в отличие от чистого растворителя, не имеет постоянной температуры кристаллизации, поскольку в первую очередь кристаллизуется растворитель, что приводит к росту концентрации и, как следствие, к понижению температуры кристаллизации раствора.
Пример 8. При какой температуре начнет кипеть и замерзать раствор неэлектролита, содержащий 0,3 моля вещества в 100 г воды? К = 1,86, Е = 0,52.
РЕШЕНИЕ. С начала определим моляльную концентрацию раствора. Она равна (см. определение моляльности) 0,3/0,1 = 3 m. Далее вычислим изменения температур кипения и замерзания раствора по формулам 1.8 и 1.9:
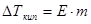 = 0,52*3 = 1,56
= 0,52*3 = 1,56
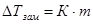 = 1,86*3 = 5,58
= 1,86*3 = 5,58
и, наконец, определим температуры кипения и замерзания раствора по шкале Цельсия, для этого воспользуемся теми же формулами 1.8 и 1.9:
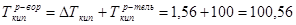 ˚С
˚С
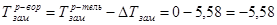 ˚С
˚С
Пример 9. Чему равно осмотическое давление раствора неэлектролита, содержащего 0,1 М в 100 мл воды при 20˚С ?
РЕШЕНИЕ. Сначала определим молярную концентрацию раствора Она, очевидно, равна 1 М. Затем определим температуру в абсолютной шкале Кельвина, она равна 20+273 = 293˚К. после этого по формуле 1.4 вычислим осмотическое давление:
Росм = CRT =1*8,3143*293 = 2436,0899 ≈2436 КПа.
|
из
5.00
|
Обсуждение в статье: Ой и 3-ий законы Рауля |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

