 |
Главная |
Задачи для самостоятельного решения
|
из
5.00
|
Вариант 1
1. В качестве жаропонижающего средства в медицине многие годы использовался антифебрин (ацетанилид) C6H5NHCOCH3. Как можно получить его из неорганических веществ? Напишите схемы возможных реакций.
2. Плотность некоторого газа по воздуху Dвозд = 2,209. Определите плотность этого газа по хлору и число молекул, содержащихся в 1 г газа.
3. Какую массу цинка и серной кислоты можно получить из цинковой обманки массой 100 т, содержащей 35 % сульфида цинка?
4. Нагрели 1 кг смеси, включающей 50 % Ca(OCl)Cl, 30 % Ca(OCl)2 и 20 % CaCl2. В результате реакции получена смесь хлората и хлорида кальция, суммарная масса которой также равна 1 кг. Вычислите массовую долю (%) в ней хлората кальция.
5. Газы, образовавшиеся при полном сгорании 1120 см3 смеси ацетилена и пропилена (н. у.), пропущены через 300 см3 0,5 моль/л раствора едкого кали. Полученный при этом раствор может поглотить еще 448 см3 диоксида углерода. Определите состав исходной смеси в процентах по объему.
6. Какой объем водорода образуется при взаимодействии 2,00 л метана (н. у.) со всем хлором, полученным при действии избытка диоксида марганца на 50 г 28,2 %-ной соляной кислоты? Приведите уравнения реакций.
Вариант 2
1. Как можно получить ацетон (диметилкетон), исходя из пропанола-1? Напишите необходимые уравнения реакций.
2. При 400 °С и определенном давлении кислород объемом 200 см3 в 1,935 раза легче, чем пары фосфора объемом 100 см3. Определите, из какого числа атомов состоит молекула парообразного фосфора при 400 °С.
3. Завод по производству серной кислоты заключил договор на поставку 5 т аккумуляторной кислоты, содержащей 35 % H2SO4 (плотность равна 1,260 г/см3). Для выполнения заказа было решено использовать 1750 кг 15,03 %-ной H2SO4 плотностью 1,102 г/см3 и 90,05 %-ную H2SO4 плотностью 1,814 г/см3: а) какую массу 90,05 %-ной кислоты необходимомо добавить к 1750 кг 15,03 %-ной кислоты, чтобы получить аккумуляторную кислоту нужной концентрации? б) какой объем воды и какая масса 90,05 %-ной кислоты потребуется для получения недостающей до 5 т аккумуляторной кислоты?
4. Газовую смесь объемом 5 л (н. у.), содержащую (объемные доли, %) HCl – 25, Cl2 – 3 и N2 – 72, пропустили через 50 г горячего раствора гидроксида калия с массовой долей КОН, равной 20 %, так что хлороводород и хлор полностью поглотилась. Какие вещества в растворе и какова их масса?
5. Смесь этана, этилена и пропилена имеет плотность по водороду, равную 15,9. К 1 л этой смеси прибавили 1 л водорода и полученную газовую смесь пропустили над нагретым платиновым катализатором. При этом ее объем уменьшился до 1,5 л (все газы измерены при нормальных условиях). Найдите состав исходной смеси в процентах по объему.
6. К 1 л смеси этана и ацетилена добавлено 2 л водорода. Полученная смесь пропущена над платиновым катализатором. Объем смеси после пропускания и приведения к исходным условиям составил 1,6 л. Определите состав исходной смеси в процентах по объему.
Вариант 3
1. Как можно получить анилин, используя в качестве исходных веществ только неорганические соединения? Укажите условия, в которых протекают предложенные вами для синтеза реакции.
2. Используемая при каталитическом окислении диоксида серы смесь этого вещества с кислородом имела плотность по кислороду 1,2. Определите состав смеси.
3. В открытой посуде нагрели хлорат калия KСlO3 массой 12 г. Через некоторое время нагревание прекратили. Масса получившегося твердого остатка составила 8 г. Какая масса хлората калия разложилась?
4. При обжиге смеси пирита FeS2 с сульфидом цинка ZnS массой 100 г выделилось 30 л (н. у.) диоксида серы. Определите состав смеси.
5. На гидролиз 2,90 г смеси фенилацетата с бензилацетатом (бензил – радикал С6Н5СН2-) потребовалось 400 мл 0,05 моль/л раствора едкого натра. Определите состав смеси исходных эфиров.
6. К 1 л смеси этана и этилена добавили 1 л водорода и полученную смесь пропустили над никелевым катализатором. Объем смеси после пропускания при тех же условиях составил 1,3 л. Установите состав исходной смеси в процентах по объему.
Вариант 4
1. Предложите способы получения этилового спирта, ацетальдегида, уксусной кислоты, хлорвинила, бензола и анилина, исходя из известняка, угля и используя только неорганические вещества. Напишите уравнения реакций.
2. Определите плотность по водороду равновесной газовой смеси NO2, NO, O2, если исходным веществом был диоксид азота, а к моменту установления равновесия 10 % его превратилось в продукты реакции.
3. В процессе гашения извести CaO подачу воды прекратили, когда масса извести увеличилась на 25 %. Полностью ли жженая известь СаО при этом превратилась в гашеную Са(ОН)2?
4. Смесь безводных нитратов бария и стронция массой 68,46 г многократным выпариванием с концентрированной соляной кислотой, а затем с водой с последующим высушиванием переведена в смесь хлоридов бария и стронция. Масса смеси равна 52,53 г. Какова масса каждой соли в исходной смеси?
5. Какое минимальное количество монохлоруксусной кислоты должно быть сожжено, чтобы после поглощения всех образовавшихся газообразных продуктов сгорания 100 г 1,12 %-ного раствора гидроксида калия не выпадал осадок от прибавления хлорида кальция?
6. Содержание предельного углеводорода в смеси, состоящей из всех углеводородов, содержащих по два атома углерода, составляет 32,8 % (по объему). 1 л смеси (условия в пересчете на нормальные) может присоединить 6,4 г брома. Найдите плотность смеси углеводородов (в г/л).
ЗАДАНИЕ 2
Задание включает следующие разделы химии: периодическая система химических элементов Д.И. Менделеева, свойства металлов, химические процессы, смеси веществ, газов, растворы, химическая связь, элементы качественного анализа.
Примеры решения задач
Пример 1.
Элементы А, В и С расположены в периодической системе химических элементов друг за другом. Соединение АС по своей твердости не уступает простому веществу, образованному одним из этих трех элементов. Из указанных элементов в соединениях между собой только два дают газообразное вещество формулы В2С2. Какие это элементы?
Решение:
Данным условия задачи соответствуют три элемента второго периода периодической системы химических элементов Д.И. Менделеева. Это А – бор (№ 5), В – углерод (№ 6) и С – азот (№ 7). Бор и азот образуют нитрид бора BN (AC), вещество по твердости не уступающее алмазу (простое вещество, аллотропная модификация углерода). Углерод и азот образуют газообразное вещество С2N2 или (СN)2 – дициан (В2С2).
Ответ: бор, углерод, азот.
Пример 2.
При обработке 0,84 г опилок сплава двух элементов избытком соляной кислоты выделилось 224 мл водорода и осталось 0,28 г нерастворимого остатка. При действии на то же количество исходного сплава избытка раствора щелочи выделилось 448 мл водорода (объемы газов измерены при нормальных условиях) и осталось 0,56 г нерастворимого остатка. Определите состав сплава.
Дано:
m (сплава) = 0,84 г
V (H2)кис. = 224 мл = 0,224 л
m (ост.)кис. = 0,28 г
V (H2)щел.. = 448 мл = 0,448 л
m (ост.)щел. = 0,56 г
Найти:
состав сплава
Решение:
Поскольку сумма масс остатков после растворения сплава в кислоте и щелочи равна массе сплава (0,28 + 0,56 = 0,84 (г)), очевидно, что в кислоте растворяется один компонент сплава массой 0,56 г, а в щелочи – второй массой 0,28 г.
Запишем схему процесса взаимодействия с кислотой:
Э1 + хHCl ® 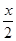 H2 + хлорид металла.
H2 + хлорид металла.
Вычислим количество вещества водорода, выделившегося в результате взаимодействия:
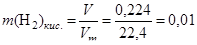 (моль).
(моль).
Если х = 1, то n (Э1) = ½ n (H2) = 0,005 моль, тогда молярная масса элемента равна:
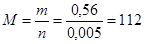 (г/моль), такого одновалентного металла не существует.
(г/моль), такого одновалентного металла не существует.
Если х = 2, то n (Э1) = n (H2) = 0,01 моль, тогда молярная масса элемента равна:
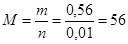 (г/моль), искомый металл железо.
(г/моль), искомый металл железо.
Уравнение реакции имеет вид:
Fe + 2HCl = FeCl2 + H2.
Запишем схему процесса взаимодействия со щелочью:
Э2 + NaOH ® 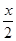 H2 + соединение элемента (соль или гидроксокомплекс).
H2 + соединение элемента (соль или гидроксокомплекс).
Вычислим количество вещества водорода, выделившегося в результате взаимодействия:
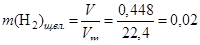 (моль).
(моль).
Если х = 1, то n (Э2) = ½ n (H2) = 0,01 моль, тогда молярная масса элемента равна:
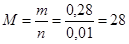 (г/моль), этот элемент кремний.
(г/моль), этот элемент кремний.
Уравнение реакции имеет вид:
Si + 2NaOH + H2O = Na2SiO3 + 2H2.
Ответ: сплав состоит из 0,28 г кремния и 0,56 г железа.
Пример 3.
В пробирках находятся растворы натриевых солей различных кислот: Na2CO3, Na2SO3, Na2S2O3, Na2S, NaNO2 и NaCl. С помощью какого реактива можно определить все шесть солей? Напишите уравнения реакций.
Решение:
Искомым реактивом является разбавленная соляная кислота. Запишем уравнения реакций с указанием признаков протекания реакций:
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O (выделяется углекислый газ – без цвета, без запаха);
Na2SO3 + 2HCl = 2NaCl + SO2↑ + H2O (выделяется сернистый газ – без цвета, с резким запахом);
Na2S2O3 + 2HCl = 2NaCl + SO2↑ + S¯ + H2O (выделяется сернистый газ – без цвета, с резким запахом и выпадает сера);
Na2S + 2HCl = 2NaCl + H2S↑ (выделяется сероводород – газ с запахом тухлых яиц);
Na2NO2 + 2HCl = 2NaCl + NO2↑ + H2O (выделяется оксид азота (IV) – газ бурого цвета с едким запахом);
NaCl + HCl ↛ (видимых изменений нет).
Ответ: разбавленная соляная кислота.
Пример 4.
Железную пластину массой 15 г опустили в раствор сульфата меди. По окончании реакции масса пластины оказалась равной 15,75 г. Определите массу растворившегося железа.
Дано:
m (пластины,1) = 15 г
m (пластины,2) = 15,75 г
M (Fe) = 56 г/моль
M (Cu) = 63,5 г/моль
Найти:
m (Fe)
Решение:
Запишем уравнение реакции:
Fe + CuSO4 = FeSO4 + Cu.
Рассчитаем, насколько изменилась масса пластины в ходе реакции:
Dm = m (пластины,2) - m (пластины,1) = 15,75 - 15 = 0,75 (г).
Рассчитаем изменение молярной массы (оно равно изменению массы при взаимодействии 1 моль веществ):
DM = M (Cu) - M (Fe) = 63,5 - 56 = 7,5 (г/моль).
Определим массу растворившегося железа:
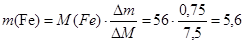 (г).
(г).
Ответ: m (Fe) = 5,6 г.
Пример 5.
Средством первой помощи при ожоге белым фосфором служит мокрая повязка, пропитанная 5 %-ным раствором CuSO4; раствор CuSO4 рекомендуется и для тушения горящего белого фосфора. Напишите уравнение химической реакции, благодаря которой белый фосфор «обезвреживается».
Решение :
Запишем уравнение реакции взаимодействия фосфора с раствором сульфата меди:
2P + 5CuSO4 + 8H2O = 2H3PO4 + 5Cu + 5H2SO4.
В результате реакции образуется фосфорная кислота и белый фосфор «обезвреживается».
Пример 6.
При нейтрализации 250 г водного раствора фенола и уксусной кислоты потребовалось 44,25 мл 12 %-ного раствора едкого натра (плотность равна 1,13 г/см3), а при действии на то же количество смеси избытка бромной воды выпало 16,55 г осадка. Определите (в процентах по массе) содержание уксусной кислоты в растворе.
Дано:
m (смеси) = 250 г
V (p-pa) = 44,25 мл
w (NaOH) = 12 %
r = 1,13 г/мл
m (осадка) = 16,55 г
M (C6H2Br3OH) = 331 г/моль
M (C6H5OH) = 94 г/моль
M (CH3COOH) = 60 г/моль
M (NaOH) = 40 г/моль
Найти:
w (CH3COOH)
Решение:
Запишем уравнения протекающих реакций:
С6Н5OH + NaOH = C6H5ONa + H2O (1)
СН3COOH + NaOH = CH3COONa + H2O (2)
С6Н5OH + 3Br2 = C6H2Br3OH¯ + 3HBr (3)
Рассчитаем количество выпавшего осадка по реакции (3):
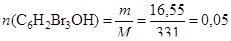 (моль).
(моль).
По уравнению реакции (3) количество вещества трибромфенола C6H2Br3OH равно количеству вещества фенола C6H5OH, следовательно, n (C6H5OH ) = 0,05 моль.
Рассчитаем количество вещества гидроксида натрия NaOH:
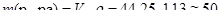 (г);
(г);
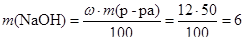 (г);
(г);
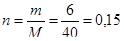 (моль).
(моль).
По уравнению (3) определили, что n (C6H5OH) = 0,05 моль. По уравнению реакции (1) количество вещества гидроксида натрия равно количеству вещества фенола, следовательно, n (NaOH), пошедшего на (1) реакцию, равно 0,05 моль. Тогда количество вещества гидроксида натрия, пошедшего на реакцию взаимодействия с кислотой, равно:
n (NaOH)2 = n (NaOH)исх - n (NaOH)1 = 0,15 - 0,05 = 0,1 (моль).
По уравнению реакции (2) количество вещества гидроксида натрия равно количеству вещества уксусной кислоты, следовательно, n (CH3COOH) 0,1 моль.
Рассчитаем массу уксусной кислоты:
m (CH3COOH) = n × M = 0,1 × 60 = 6 (г).
Определим процентное содержание уксусной кислоты в растворе:
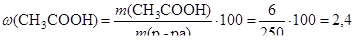 (%).
(%).
Ответ: w (СН3СООН) = 2,4 %.
Пример 7.
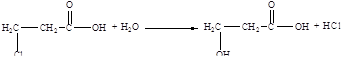
Напишите структурные формулы нескольких реально существующих, по вашему мнению, изомеров вещества состава С3Н5ClO2 и напишите одно – два уравнения реакции, характеризующие химические свойства этих изомеров.
Решение:
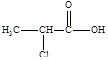
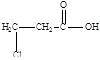
2-хлорпропионовая кислота 3-хлорпропионовая кислота
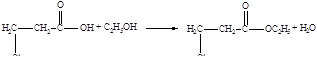
Пример 8.
Имеется смесь двух газов, характеризующаяся следующими свойствами: 1) при пропускании этой смеси объемом 10 л через раствор гидроксида кальция образуется соль массой 10 г; 2) при пропускании этой смеси объемом 5 л через раствор серной кислоты образуется соль массой 11,43 г. Определите качественный и количественный состав смеси, если ее плотность по водороду равна 11,52.
Дано:
V (смеси)1 = 10 л
m (соли)1 = 10 г
V (смеси)2 = 5 л
V (смеси)2 = 11,43 г
D (H2) = 1,52
M (CaCO3) = 100 г/моль
M ((NH4)2SO4) = 132 г/моль
Найти:
j1
j2
Решение:
Газ, взаимодействующий с H2SO4, имеет основный характер (например, аммиак NH3). Запишем уравнение реакции взаимодействия аммиака с серной кислотой:
2NH3 + H2SO4 = (NH4)2SO4.
Тогда образующаяся соль – это сульфат аммония, определим количество вещества (NH4)2SO4:
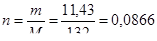 (моль).
(моль).
Определим количество аммиака. По уравнению реакции на 1 моль серной кислоты приходится 2 моль аммиака, поэтому количество вещества аммиак равно 0,1732 моль (2 × 0,0866). Рассчитаем объем газа:
V (NH3) = n × Vm = 0,1732 × 22,4 = 3,88 (л).
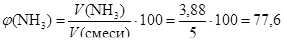 (%).
(%).
Газ, образующий соль с Са(ОН)2, имеет кислотный характер (например, HCl, H2S, SO2, SO3, CO2 и т.д.).
jх = 100 - 77,6 = 22,4 (%)
По закону Авогадро, j (NH3) × M (NH3) + j (NH3) × M (NH3) = D (H2) × M (H2). Отсюда,
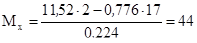 (г/моль).
(г/моль).
Полученное значение соответствует молярной массе углекислого газа СО2.
Сделаем проверку полученного результата по первому условию, запишем уравнение реакции взаимодействия углекислого газа и гидроксида кальция.
CO2 + Ca(OH)2 = CaCO3 + H2O.
Вычислим объем углекислого газа в смеси объемом 10 л:
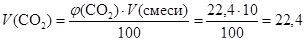 (л); тогда
(л); тогда
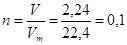 (моль).
(моль).
По уравнению реакции количество вещества углекислого газа равно количеству вещества карбоната кальция, т.е. n (CaCO3) = 0,1 моль. Тогда масса карбоната кальция равна:
M (CaCO3) = n × M = 0,1 × 100 = 10 (г). что соответствует условию задачи, следовательно, смесь состоит из аммиака (77,6 %) и углекислого газа (22,4 %).
Ответ: j (NH3) = 77,6 %; j (CO2) = 22,4 %.
|
из
5.00
|
Обсуждение в статье: Задачи для самостоятельного решения |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

