 |
Главная |
Задачи для самостоятельного решения
|
из
5.00
|
Вариант 1
1. Выведите структурные формулы всех изомерных предельных углеводородов, содержащих шесть атомов углерода в молекуле. Назовите углеводороды по систематической номенклатуре.
2. Напишите сокращенную структурную формулу каждого из следующих соединений: 2-метилпентан; 2,3,4,4-тетраметилпентен-2; гексин-3; 1,2,3-триметилбензол.
3. При каталитическом дегидрировании смеси бензола, циклогексана и циклогексена получено 23,4 г бензола и выделилось 11,2 л водорода. Известно, что исходная смесь может присоединить 16 г брома. Определите состав (% по массе) исходной смеси.
4. Этиленовый углеводород массой 7 г присоединяет 2,24 л бромоводорода. Определите молярную массу и строение этого углеводорода, если известно, что он является цис-изомером.
5. Напишите формулу углеводорода, который получится в результате взаимодействия 3,3-диметилбутена-1 с бромом, а затем с избытком спиртового раствора щелочи при нагревании.
6. Покажите смещение электронной плотности и знак заряда на атомах углерода в о- и п-положениях бензольного кольца в следующих молекулах: карболовая кислота, нитробензол.
7. Предложите способ выделения бензола из смеси бензола со стиролом (фенилэтилен).
8. Если при одинаковых условиях гидрировать раздельно этилен и ацетилен, то за определенное время степень гидрогенизации этилена превышает соответствующую величину для ацетилена. Если же гидрировать их смесь, то в первую очередь гидрируется ацетилен. При гидратации смеси этилена и пропилена в первую очередь гидрируется этилен. Объясните эти явления.
9. Толуол, хлорбензол, нитробензол вступают в реакцию электрофильного замещения с бромом при наличии избытка вещества (т.е. предполагается образование только монобромпроизводного). Расположите вещества в порядке возрастания массовой доли выхода пара-изомера и дайте объяснения.
10. Газ, выделившийся при получении бромбензола из 22,17 мл бензола (плотность = 0,88 г/см3), ввели в реакцию с 4,48 л (н. у.) изобутилена. Определите состав и массу образовавшихся веществ, учитывая, что выход бромбензола составляет 80 % от теоретического, а реакция с изобутиленом идет с количественным выходом.
Вариант 2
1. Укажите углеводороды, которые относятся к алканам, и дайте им названия: С5Н12; С7Н14; С6Н6; С2Н2; С22Н44.
2. Напишите сокращенную структурную формулу каждого из следующих соединений: 4-этилгептан; 3-метил-4этилгексен-3.
3. Ароматический углеводород состава С8Н8 обесцвечивает бромную воду. При каталитическом гидрировании этого углеводорода образуется этилциклогексан. Установите строение углеводорода. Определите объем водорода, который потребуется для гидрирования 52 г этого углеводорода, если реакция протекает с 80 %-ным выходом.
4. Определите молярную массу и напишите структурные формулы всех возможных изомеров этиленового углеводорода, если известно, что 1,12 г его могут обесцветить 8 г 40 %-ного раствора брома в хлороформе.
5. Напишите реакции получения бутина-2 из бутанола-1.
6. Покажите смещение электронной плотности и знак заряда на атомах углерода в о- и п-положениях бензольного кольца в следующих молекулах: этилбензол, нитробензол.
7. Напишите продукты окисления перманганатом калия этилбензола и п-ксилола.
8. Укажите преимущественное направление реакции бромирования по механизму электрофильного замещения мета- и пара-фтортолуола.
9. Этилен гидрируется легче других алкенов, но присоединение галогенов и галогеноводородов протекает легче для гомологов этилена, чем для С2Н4. Объясните эти факты.
10. При окислении смеси бензола и толуола раствором перманганата калия при нагревании получено после подкисления 8,54 г одноосновной органической кислоты. При взаимодействии этой кислоты с избытком водного раствора гидрокарбоната натрия выделился газ, объем которого в 19 раз меньше объема такого же газа, полученного при сгорании исходной смеси углеводородов. Определите состав исходной смеси (в % по массе).
Вариант 3
1. Напишите структурные формулы всех возможных изомерных радикалов и назовите их: С2Н5-; С3Н7-.
2. Напишите сокращенную структурную формулу каждого из следующих соединений: 2-метил-4-этилгексан; 2,3-диметил-бутен-2; диэтилацетилен; 1-метил-2-этилбензол.
3. Рассчитайте массу н-гептана, которая потребуется для получения из него толуола в процессе циклизации и дегидрирования, чтобы выделившегося при этом водорода было достаточно для гидрирования 84 г гексена-1. Определите массу получившегося толуола.
4. Определите объем водорода, который потребуется для каталитического гидрирования 20 г смеси, содержащей 42 % гексена и 58 % пентена (по массе).
5. Химическим путем докажите, что в первой пробирке находится пропан, а во второй – пропин.
6. Покажите смещение электронной плотности и знак заряда на атомах углерода в о- и п-положениях бензольного кольца в следующих молекулах: фенол, бензойная кислота.
7. Объясните, почему бензол не обесцвечивает бромную воду и водный раствор перманганата калия.
8. Докажите, что ацетилен в отличие от этана и этена способен легко замещать атомы водорода на атомы металла.
9. С ростом числа атомов углерода в молекуле число возможных изомеров у алкинов больше, чем у алканов, но меньше, чем у алкенов, даже если учитывать геометрическую изомерию. Объясните этот факт.
10. Смесь бензола, циклогексена и циклогексана при обработке бромной водой присоединяет 16 г брома; при каталитическом дегидрированиии исходной смеси образуется 39 г бензола и водород, объем которого в 2 раза меньше объема водорода, необходимого для полного каталитического гидрирования исходной смеси углеводородов. Определите состав исходной смеси углеводородов (в % мольных).
Вариант 4
1. Напишите молекулярные формулы предельных углеводородов, содержащих пять, девять и двадцать атомов углерода в молекуле.
2. Напишите сокращенную структурную формулу каждого из следующих соединений: 2,2,4-триметилпентан; 2-метил-бутен-1; гексин-2; 1,2,3-триметилбензол.
3. При нагревании 13,8 г ароматического углеводорода А, содержащего одну алкильную группу с перманганатом калия, получено после подкисления вещество В, для нейтрализации которого требуется 30 г 20 %-ного раствора гидроксида натрия. Определите строение исходного углеводорода А.
4. Смесь этана, пропилена и ацетилена занимает объем 448 мл и может обесцветить 40 мл 5 %-ного раствора брома в тетрахлорметане (плотность = 1,6 г/см3). Минимальный объем 40 %-ного раствора гидроксида калия (плотность = 1,4 г/см3), которым можно поглотить весь оксид углерода (IV), образовавшийся при полном сгорании исходной смеси, равен 5 мл. Определите содержание газов (в % по объему) в исходной смеси. Объемы газов измерены при нормальных условиях.
5. Укажите, какой из двух изомерых газообразных углеводородов является ацетиленовым, а какой диеновым – на примере бутина-1 и бутадиена-1,3.
6. Покажите смещение электронной плотности и знак заряда на атомах углерода в о- и п-положениях бензольного кольца в следующих молекулах: толуол, карболовая кислота.
7. Напишите уравнения реакций трех способов синтеза бензола.
8. Объясните, в каких случаях присоединение водородсодержащих соединений к алкенам идет против правила Марковникова.
9. Бензойная кислота, этиловый эфир бензойной кислоты, нитробензол вступают в реакцию электрофильного замещения с бромом при наличии избытка вещества (т.е. предполагается образование только монобромпроизводного). Расположите вещества в порядке возрастания массовой доли выхода пара-изомера и дайте объяснения.
10. Смесь циклогексена и циклогексана может обесцветить 320 г 10 %-ного раствора брома в СCl4. Определите состав смеси углеводородов (в % по массе), если известно, что при полном дегидрировании этой смеси с образованием бензола выделяется водород в количестве, достаточном для исчерпывающего гидрирования 11,2 л дивинила.
ЗАДАНИЕ 3
Задание включает материал раздела органической химии «Кислородсодержащие соединения»: спирты, фенолы, карбоновые кислоты, альдегиды, сложные эфиры, жиры, углеводы.
Примеры решения задач
Пример 1.
Напишите все изомеры вторичных спиртов гексанола и назовите их по заместительной номенклатуре.
Решение:
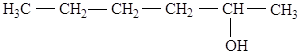
гексанол-2

гексанол-3
 4-метилпентанол-2
4-метилпентанол-2

3-метилпентанол-2

4-метилпентанол-3

3,3-диметилбутанол-2.
Пример 2.
На нейтрализацию смеси фенола и этанола затрачен раствор объемом 50 мл с массовой долей гидроксида натрия 18 % и плотностью 1,2 г/мл. Такая же масса смеси реагирует с металлическим натрием массой 9,2 г. Определите массовые доли фенола и этанола в смеси.
Дано:
V (р-ра NaOH) = 50 мл
w (NaOH) = 18 %
r = 1,2 г/мл
m (Na) = 9,2 г
M (C6H5OH) = 94 г/моль
M (C2H5OH) = 46 г/моль
M (Na) = 23 г/моль
M (NaOH) = 40 г/моль
Найти:
w (C6H5OH)
w (C2H5OH)
Решение:
С раствором гидроксида натрия реагирует только фенол, этанол не взаимодействует. С металлическим натрием реагируют оба компонента смеси. Запишем уравнения реакций:
C6H5OH + NaOH = C6H5ONa + H2O (1)
C6H5OH + Na = C6H5ONa + ½ H2 (2)
C2H5OH + Na = C2H5ONa + ½ H2 (3).
По уравнению (1) рассчитаем количество вещества фенола в смеси. Определим количество вещества гидроксида натрия в 50 мл 18 %-ного раствора. Масса раствора равна:
m (p-pa) = V × r = 50 × 1,2 = 60 (г), тогда
 (г), следовательно,
(г), следовательно,
 (моль).
(моль).
По уравнению реакции (1) соотношение n (C6H5ОН) : n (NaOH) равно 1 : 1, следовательно, в реакцию вступило 0,27 моль фенола. Вычислим его массу:
m (C6H5ОН) = n × M = 0,27 × 94 = 25,38 (г).
По уравнению реакции (2) с фенолом реагирует 0,27 моль натрия (соотношение n (C6H5ОН) : n (Na) равно 1 : 1). Остальной натрий реагирует по уравнению (3) с этанолом. Вычислим количество вещества натрия, вступившего в реакции (2) и (3):
 (моль), тогда на реакцию (3) расходуется:
(моль), тогда на реакцию (3) расходуется:
n3 (Na) = n (Na) – n2 (Na) = 0,4 – 0,27 = 0,13 (моль).
Следовательно, этанола в смеси 0,13 моль (по уравнению (3) соотношение n (C2H5ОН) : n (Na) равно 1 : 1). Вычислим массу этанола:
m (C2H5ОН) = n × M = 0,13 × 46 = 5,98 (г).
Общая масса смеси равна:
m (смеси)= m (C2H5ОН) + m (C6H5ОН) = 5,98 + 25,38 = 31,36 (г).
Рассчитаем массовые доли компонентов в смеси:
 (%);
(%);
 (%).
(%).
Ответ: w (C6H5OH) = 80,93 %, w (C2H5OH) = 19,07 %.
Пример 3.
Напишите уравнения реакций, которые нужно провести для осуществления следующей цепочки превращения: CH3COH ® С2Н5ОН ® С2Н4 ® НОСН2 – СН2ОН.
Решение:
1) Восстановление уксусного альдегида при нагревании в присутствии никелевого катализатора:
CH3COH + [H] ® С2Н5ОН.
2) Дегидратация этанола при действии избытка концентрированной серной кислоты при температуре 170 °С:
С2Н5ОН 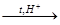 С2Н4.
С2Н4.
3) Мягкое окисление этилена водным раствором перманганата калия (реакция Вагнера):
3С2Н4 + 2KMnO4 + 4H2O = 3НОСН2 - СН2ОН + 2MnO2 + 2KOH.
Пример 4.
При окислении неизвестного кислородсодержащего предельного органического соединения массой 1,8 г аммиачным раствором нитрата серебра получили серебро массой 5,4 г. Определите состав органического вещества, подвергнутого окислению.
Дано:
m (CxHyOz) = 1,8 г
m (Ag) = 5,4 г
M (Ag) = 107,8 г/моль
Найти:
CxHyOz
Решение:
С аммиачным раствором нитрата серебра с образованием металлического серебра взаимодействуют альдегиды (реакция «серебряного зеркала»), следовательно, искомый кислородсодержащий углеводород имеет общую формулу R – COH. Запишем уравнение реакции:
R – COH + 2[Ag(NH3)2](OH) = R – COONH4 + 2Ag¯ + 3NH3 + H2O.
Вычислим количество вещества образовавшегося серебра:
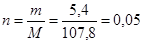 (моль), следовательно,
(моль), следовательно,
количество вещества альдегида равно 0,025 моль (n (R – COH) : n (Ag) равно 1 : 2). Вычислим молярную массу альдегида:
 (г/моль).
(г/моль).
Общая формула предельных альдегидов: CnH2n+1COH. Молярная масса определяется следующим образом:
M (CnH2n+1COH) = n × M (C) + (n + 1) × M (H) + M (C) + M (O) + M (H) = n × 12 + (2n + 1) × 1 + 12 + 16 + 1 = 14n + 30 = 72 (г/моль).
Получили: 14n + 30 = 72, n = 3, искомый альдегид – C3H7COH – бутаналь.
Ответ: C3H7COH.
Пример 5.
Определите массу этилацетата, который можно получить в реакции этерификации этанола массой 1,61 г и уксусной кислоты массой 1,80 г, если выход продукта составляет 75 %.
Дано:
m (C2H5OH) = 1,61 г
m (CH3СOOH) = 1,80 г
h (CH3СOOC2H5) = 75 %.
M (C2H5OH) = 46 г/моль
М (CH3СOOH) = 60 г/моль
М (CH3СOOC2H5) = 88 г/моль
Найти:
m (CH3СOOC2H5)
Решение:
Запишем уравнение реакции взаимодействия этилового спирта с уксусной кислотой:
C2H5OH + CH3СOOH = CH3СOOC2H5 + Н2О.
Так как по условию задачи даны массы спирта и кислоты, рассчитаем количество вещества и определим, какое из веществ взято в избытке:
 (моль);
(моль);
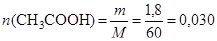 (моль).
(моль).
По уравнению реакции соотношение n (C2H5OH) : n (CH3СOOH) равно 1 : 1, по условию задачи соотношение n (C2H5OH) : n (CH3СOOH) равно 0,035 : 0,030, следовательно, спирт взят в избытке, расчеты проводим по кислоте.
В реакцию вступило 0,03 моль уксусной кислоты, следовательно образовалось 0,03 моль этилацетата (n (CH3СOOC2H5) : n (CH3СOOH) равно 1 : 1), вычислим его массу:
m (CH3СOOC2H5) = n × M = 0,03 88 = 2,64 (г).
Это масса, рассчитанная по уравнению реакции, или теоретический выход. Определим практическую массу этилацетата, учитывая, что выход продукта составляет 75 %:
 (г).
(г).
Ответ: m (CH3СOOC2H5) = 1,98 г.
Пример 6.
Напишите уравнения и условия протекания реакций, при помощи которых можно осуществить следующие превращения: оксид углерода (IV) ® крахмал ® глюкоза ® этиловый спирт.
Решение:
1) Крахмал образуется в растениях при фотосинтезе:
6CO2 + 6H2O  = C6H12O6 + 6O2, затем глюкоза превращается в крахмал:
= C6H12O6 + 6O2, затем глюкоза превращается в крахмал:
nC6H12O6 = (C6H10O5)n + nH2O.
2) При нагревании в кислой среде происходит гидролиз крахмала и образование a-глюкозы:
(C6H10O5)n + nH2O = nC6H12O6.
3) Под действием ферментов происходит спиртовое брожение глюкозы:
C6H12O6  2C2H5OH + 2CO2.
2C2H5OH + 2CO2.
|
из
5.00
|
Обсуждение в статье: Задачи для самостоятельного решения |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

