 |
Главная |
Задачи для самостоятельного решения
|
из
5.00
|
Вариант 1
1. Укажите, в каком виде встречается сера в природе, какие изменения происходят с серой при нагревании, как изменяется состав молекул серы при переходе из твердого состояния в жидкое и парообразное.
2. Укажите промышленные способы получения азотной кислоты. Напишите уравнения реакций получения HNO3.
3. К 101 мл 20 %-ного раствора хлорида аммония (плотность 1,06 г/мл) прибавили 125 мл 18 %-ного раствора гидроксида натрия (плотность 1,2 г/мл) и полученный раствор прокипятили. Вычислите массовые доли (%) веществ, содержащихся в растворе, если потерями воды можно пренебречь.
4. В склянках без надписей находятся растворы соляной и серной кислот, вода, а также сухие соли – карбонат серебра, нитрат и иодид бария, карбонат и бромид кальция. Не прибегая к действию других химических реактивов, кроме упомянутых, или продуктов их взаимодействия, определите эти соединения. Напишите уравнения соответствующих реакций и укажите признаки, по которым вы проводили определение веществ.
5. Напишите уравнения реакций, при помощи которых, исходя из четырех простых веществ – калия, серы, кислорода и водорода, можно получить три средние соли, три кислоты и три кислые соли.
6. При взаимодействии угля с углекислым газом наблюдается обратимая реакция: С + СО2 ⇄ 2СО - Q. Объясните, при каких условиях образование угарного газа минимальное.
7. Аммиак объемом 100 м3 (н. у.) пропустили через реактор, заполненный 500 кг 50 %-ного раствора ортофосфорной кислоты. Определите состав (в процентах по массе) полученной смеси солей.
8. Два простых вещества при сгорании дают газообразные продукты. Один газ имеет сильный резкий запах, второй – не пахнет. При растворении их в воде получаются жидкости, окрашивающие лакмус в красный цвет. При пропускании газов через раствор гидроксида кальция образуются белые осадки, растворяющиеся при добавлении избытка газа. Если смешать каждый их этих газов с оксидом азота (IV), то в случае одного из газов возникает белый дым, в случае другого видимых изменений не обнаружено. Определите, какие вещества были сожжены.
9. Верно ли, что гидролиз – это реакция, обратная нейтрализации? Дайте обоснованный ответ.
10. Через колонну синтеза аммиака пропущено 100 кг газовой смеси, массовая доля водорода в которой составляет 15 %. Вычислите состав газовой смеси (в процентах) после выхода из колонны, если реакция прошла на 80 %.
Вариант 2
1. Укажите, в каком виде встречается фосфор в природе, назовите аллотропные модификации фосфора.
2. Укажите, какие химические процессы лежат в основе башенного и контактного способов получения серной кислоты. Напишите уравнения реакций получения H2SO4.
3. Газ, полученный при взаимодействии 9,52 г меди с 50 мл 81 %-ного раствора азотной кислоты (плотность 1,45 г/мл), пропустили через 150 мл 20 %-ного раствора гидроксида натрия (плотность 1,22 г/мл). Определите массовые доли (%) растворенных веществ.
4. В трех пробирках находятся растворы нитрата серебра, иодида калия и хлорида кальция. С помощью каких реакций можно определить содержимое каждой пробирки?
5. Напишите уравнения реакций, при помощи которых можно получить шесть средних солей, используя сульфид железа (II), кислород, раствор гидроксида натрия и разбавленные растворы соляной и серной кислот.
6. Изменится ли давление в замкнутой системе, если при нормальных условиях смешать равные объемы хлора и водорода и облучить смесь ультрафиолетовыми лучами? Ответ поясните.
7. Определите молярную концентрацию азотной кислоты, полученной смешиванием 40 мл 96 %-ного раствора HNO3 (плотность 1,5 г/мл) и 30 мл 48 %-ного раствора HNO3 (плотность 1,3 г/мл), если полученный раствор имеет плотность 1,45 г/мл.
8. В вашем распоряжении имеются бертолетова соль, серная кислота, бромид калия, аммиак, диоксид марганца. Пользуясь этими веществами, получите соляную кислоту, хлор, нашатырь, свободный азот, бром (при необходимости можно использовать воду и кислород воздуха). Напишите уравнения соответствующих реакций и укажите условия, при которых они происходят.
9. Объясните, будут ли подвергаться гидролизу соли, формулы которых K3PO4, CrCl3, FeCO3, KNO3. Укажите соль, которая не подвергается гидролизу, дайте пояснения. Для других солей напишите уравнения реакций гидролиза по стадиям и укажите, будет ли данный раствор кислым или щелочным.
10. Фосфористый водород, полученный гидролизом 145,6 г фосфида кальция, сожгли. Образовавшийся оксид фосфора (V) растворили в 200 мл 25 %-ного раствора гидроксида натрия (плотность 1,28 г/мл). Определите, какого состава образуется соль и какова ее массовая доля (%) в растворе. Напишите уравнения протекающих реакций.
Вариант 3
1. Укажите, в каком виде встречается кислород в природе, назовите аллотропные модификации кислорода.
2. Дайте характеристику основных физических и химических свойств аммиака. При какой температуре аммиак может быть получен в жидком состоянии? Чем можно объяснить различную электропроводность жидкого аммиака и раствора металлического натрия в жидком аммиаке? Укажите области применения аммиака в современной технике.
3. При растворении в 50 мл 25 %-ного раствора гидроксида натрия (плотность 1,28 г/мл) всего оксида серы (IV), образовавшегося при сжигании 8,96 л сероводорода, получают раствор соли. Определите, какая соль образуется и какова ее массовая доля (%) в растворе.
4. В четырех пронумерованных банках без этикеток находятся следующие вещества: нитрит, сульфит, карбонат натрия и хлорид бария. Определите, в какой из банок находится каждое вещество, если известно, что вещества № 1, 2, 3 реагируют с соляной кислотой с выделением газов. Газы, образующиеся из веществ № 1 и 2, могут реагировать между собой, а растворы веществ № 2 и 3 реагируют с раствором № 4 с образованием осадков.
5. Укажите, с какими из перечисленных ниже веществ может взаимодействовать раствор гидроксида калия: йодоводородная кислота, хлорид меди (II), хлорид бария, оксид углерода (IV), оксид свинца (II). Напишите уравнения реакций в молекулярной, ионной и сокращенной ионной формах.
6. Объясните, как будет влиять увеличение температуры на состояние равновесия в следующих реакциях: а) H2 + Br2 ⇄ 2HBr + Q; б) H2 + I2 Û 2HI - Q.
7. Упарили вдвое (по объему) 4 л 10 %-ного раствора хлорида натрия (плотность 1,07 г/мл). Определите молярную концентрацию нового раствора.
8. Как, имея в своем распоряжении только S, Cu(NO3)2 и Н2О, получить H2SO4? Приведите уравнения реакций.
9. Напишите в молекулярной и ионной формах уравнения реакций и объясните механизм их протекания: а) Fe2(SO4)3 + Na2CO3 + H2O ®; б) AlCl3 + (NH4)2S + H2O ®.
10. Фосфор, количественно выделенный из 31 г фосфата кальция Ca3(PO4)2, окислен в атмосфере кислорода, полученный препарат растворен в 200 мл 1,5 моль/л раствора гидроксида калия. Определите, какие вещества и в каком количестве содержатся в образовавшемся растворе. Напишите уравнения протекающих реакций.
Вариант 4
1. Укажите, какие степени окисления проявляет азот в своих соединениях (какая степень окисления максимальна), приведите примеры соединений.
2. Назовите ряд способов (не менее 8) получения кислорода, которые могут быть использованы в лабораторных условиях. Почему все они не имеют промышленного значения?
3. Вычислите, какую массу оксида серы (VI) надо растворить в 100 г 91 %-ного раствора серной кислоты для того, чтобы получить 30 %-ный олеум.
4. Можно ли, используя один химический реактив (только один!), различить водные растворы сульфатов серебра, калия, магния, кальция, алюминия и аммония? Поясните, как это сделать. Если это невозможно, укажите набор необходимых реактивов и опишите ход анализа. Приведите уравнения соответствующих реакций.
5. Напишите уравнения не менее четырех реакций, при помощи которых можно получить сульфид калия. Уравнения запишите в молекулярной, ионной и сокращенной ионной формах.
6. Объясните, как будет влиять увеличение давления на состояние равновесия в следующих реакциях: а) H2 + Cl2 ⇄ 2HCl; б) 2NO + O2 ⇄ 2NO2.
7. Вычислите, сколько граммов оксида серы (VI) надо растворить в 100 г 96,4 %-ного раствора серной кислоты для получения 20 %-ного раствора оксида серы (VI) в 100 %-ном растворе серной кислоты (т.е. 20 %-ного олеума).
8. 12,4 г простого вещества А красного цвета сожгли в избытке воздуха. В результате образовался белый порошок В, который растворили в 471,6 мл горячей воды, получив раствор С. Если раствор С нейтрализовать содой, а затем добавить избыток нитрата серебра, то выпадет ярко-желтый осадок. Назовите вещества А, В и С. Рассчитайте, сколько граммов порошка В образовалось.
9. Напишите в молекулярной и ионной формах уравнения реакций и объясните механизм их протекания: а) Cr2(SO4)3 + (NH4)2S + H2O ®; б) CuSO4 + Na2CO3 + H2O ® [Cu(OH)]2CO3 + … .
10. Вычислите, какое количество фосфорита, содержащего 25 % посторонних примесей, необходимо переработать для получения 500 т двойного суперфосфата, считая выход продукта равным 98 %.
ЗАДАНИЕ 3
Задание является завершающим, поэтому включает материал практически по всем темам, изучаемым в 9 классе.
Примеры решения задач
Пример 1.
В четырех пробирках без надписей находятся растворы следующих веществ: сульфата натрия, карбоната натрия, нитрата натрия и йодида натрия. Покажите, с помощью каких реагентов можно определить, где какая соль находится. Напишите уравнения реакций в молекулярной и ионной формах.
Решение:
1. К растворам прильем раствор хлорида бария. В пробирках, содержащих сульфат натрия и карбонат натрия, выпадают белые осадки:
Na2SO4 + BaCl2 = 2NaCl + BaSO4¯;
SO42- + Ba2+ = BaSO4;
Na2CO3 + BaCl2 = 2NaCl + BaCO3¯;
CO32- + Ba2+ = BaCO3.
2. К полученным осадкам приливаем раствор соляной кислоты. Карбонат бария растворяется с образованием газообразного оксида углерода (IV), а сульфат бария не растворяется:
BaCO3 + 2HCl = BaCl2 + Н2O + CO2;
BaCO3 + 2H+ = Ba2+ + Н2O + CO2.
Таким образом, определили сульфат натрия и карбонат натрия.
3. К оставшимся растворам нитрата натрия и йодида натрия прильем раствор нитрата серебра. В пробирке, содержащей йодид натрия, выпадает желтый творожистый осадок:
NaI + AgNO3 = NaNO3 + AgI¯;
I- + Ag+ = AgI.
В пробирке, содержащей нитрат натрия, ничего не происходит.
Определили йодид натрия и нитрат натрия.
Пример 2.
Укажите, с помощью каких реакций можно синтезировать нитрат аммония из простых веществ. Каким образом из него получаются свободные кислород, водород, азот? Напишите уравнения соответствующих реакций.
Решение:
1. Прямой синтез нитрата аммония NH4NO3 из простых веществ, конечно, невозможен.
Из простых веществ получим аммиак NH3:
N2 + 3H2 = 2NH3 (катализатор – губчатое железо, с добавками Al2O3, K2O, CaO, MgO, SiO2 и др.; температура – 450–500 °С; давление – от 10 до 300 атм.).
Из аммиака получим азотную кислоту:
4NH3 + 5O2 = 4NO + 6H2O (на платиновом катализаторе при 500 °С);
2NO + O2 = 2NO2;
4NO2 + О2 + 2H2O = 4HNO3 (в присутствии избытка кислорода).
Аммиак реагирует с азотной кислотой с образованием нитрата аммония:
NH3 + HNO3 = NH4NO3.
2. Получить кислород, водород и азот термическим разложением нитрата аммония невозможно, нитрат аммония разлагается на оксид азота (I) и воду:
NH4NO3 = N2O + 2H2O.
Собираем газ и конденсируем воду, затем проводим электролиз воды, в результате образуются водород и кислород:
2H2O  2H2 + O2
2H2 + O2
Оксид азота (I) можно разложить на азот и кислород, но их трудно разделить, поэтому подвергнем его взаимодействию с водородом:
N2O + H2 = N2 + H2O.
Получили азот.
Пример 3.
Имеется раствор, содержащий одновременно серную и азотную кислоты. Определите массовую долю (%) каждой из кислот в растворе, если при нейтрализации 10 г этого раствора расходуется 12,5 мл 19 %-ного раствора гидроксида калия (плотность 1,19 г/мл), а при добавлении к 10 г такого же раствора избытка хлорида бария образуется 2,33 г осадка.
Дано:
m (p-pa) = 10 г
V (р-ра KOH) = 12,5 мл
w (KOH) = 19 %
r = 1,19 г/мл
m (осадка) = 2,33 г
M (BaSO4) = 233 г/моль
M (HNO3) = 63 г/моль
M (H2SO4) = 98 г/моль
M (KOH) = 56 г/моль
Найти:
w (H2SO4)
w (HNO3)
Решение:
С раствором гидроксида калия реагирует серная и азотная кислота, а с раствором хлорида бария – только серная кислота, поэтому сначала определим массу серной кислоты, содержащейся в растворе.
Запишем уравнение реакции взаимодействия серной кислоты и хлорида бария:
BaCl2 + H2SO4 = BaSO4¯ + 2HCl.
По условию задачи масса образующегося сульфата бария равна 2,33 г. Определим количество вещества сульфата бария:
 (моль).
(моль).
Следовательно, серной кислоты в растворе содержится также 0,01 моль (соотношение n (H2SO4) : n (BaSO4) равно 1 : 1). Вычислим массу серной кислоты:
m = n × M = 0,01 × 98 = 0,98 (г).
Вычислим массу азотной кислоты, содержащейся в растворе. Запишем уравнения реакций взаимодействия азотной и серной кислот с гидроксидом калия:
HNO3 + KOH = KNO3+ H2O. (1)
H2SO4 + 2KOH = K2SO4 + 2H2O. (2)
Определим количество вещества гидроксида калия, вступившего в реакции. Масса раствора гидроксида калия равна:
m (р-ра) = V × r = 12,5 × 1,19 = 14,88 (г),
тогда масса вещества равна:
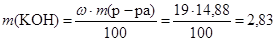 (г).
(г).
Вычислим количество вещества гидроксида калия:
 (моль).
(моль).
На реакцию взаимодействия гидроксида калия с серной кислотой (2) в количестве 0,01 моль расходуется 0,02 моль KOH (соотношение n (H2SO4) : n (KOH) равно 1 : 2). Тогда на реакцию с азотной кислотой (1) останется 0,03 моль (0,05 – 0,02) KOH. Следовательно, азотной кислоты в растворе содержится 0,03 моль (соотношение n (HNO3) : n (KOH) равно 1 : 1). Определим массу азотной кислоты:
m = n × M = 0,03 × 63 = 1,89 (г).
Таким образом, исходный раствор содержит: 0,98 г H2SO3; 1,89 г HNO3, масса раствора равна 10 г. Определим массовые доли кислот в растворе:
 (%);
(%);
 (%).
(%).
Ответ: w (H2SO4) = 9,8 %; w (HNO3) = 18,9 %.
Пример 4.
Укажите, какой состав имеют цинковые белила, напишите уравнения реакций их получения.
Решение:
Цинковые белила – оксид цинка ZnO.
Получается при горении металлического цинка:
2Zn + O2 = 2ZnO;
при термическом разложении солей:
ZnCO3 = ZnO + CO2;
в промышленности – при переработке цинковых сульфидных руд:
2ZnS + 3O2 = 2ZnO + 2SO2.
Пример 5.
Вычислите, какую массу (в кг) кальциевой селитры, используемой в качестве удобрения, можно получить из 148 кг гашеной извести, содержащей 8 % посторонних примесей.
Дано:
m (гаш. извести) = 148 кг
w (примесей) = 8 %
М (Ca(OH)2) = 74 г/моль
М (Ca(NO3)2) = 164 г/моль
Найти:
m (Ca(NO3)2)
Решение:
Нитрат калия образуется при взаимодействии гашеной извести (основной компонент – гидроксид кальция) с азотной кислотой:
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O.
Вычислим массу гидроксида кальция, содержащуюся в гашеной извести.
Поскольку массовая доля примесей составляет 8 %, то массовая доля гидроксида кальция составляет 92 % (100 – 8). Из определения массовой доли масса гидроксида кальция равна:
 (кг).
(кг).
Определим количество вещества гидроксида кальция:
 (кмоль).
(кмоль).
По уравнению реакции из 1 моля гидроксида кальция образуется 1 моль нитрата кальция, следовательно, из 1,84 кмоль гидроксида кальция образуется 1,84 моль нитрата кальция. Вычислим массу нитрата кальция:
m = n × M = 1,84 × 164 = 301,76 (кг).
Ответ: m (Ca(NO3)2) = 301,76 кг
Пример 6.
В следующих схемах расставьте коэффициенты и укажите степень окисления элементов, изменивших ее в процессе реакции:
а) Na2S2O3 + H2SO4 ® Na2SO4 + SO2 + S + H2O;
б) PCl5 ® PCl3 + Cl2.
Решение:
а) Na2S2O3 + H2SO4 ® Na2SO4 + SO2 + S + H2O.
Расставим степени окисления всех элементов:
Na2+S2-2, +6O3-2 + H2+S+6O4-2 ® Na2+S+6O4-2 + S+4O2-2 + S0 + H2+O-2.
В тиосульфат-ионе S2O32- сера находится в двух степенях окисления +6 и -2. Структурная формула имеет вид:

Тиосульфат-ион является одновременно окислителем (сера в степени окисления +6) и восстановителем (сера в степени окисления -2). В результате образуется оксид серы (IV) (сера в степени окисления +4) и свободная сера (сера в степени окисления 0). Запишем полуреакции процессов окисления и восстановления:
S2O32- + H2O – 4  ® 2SO2 + 2H+ (процесс окисления; S2O32- – восстановитель);
® 2SO2 + 2H+ (процесс окисления; S2O32- – восстановитель);
S2O32- + 6H+ + 4  ® 2S + 3H2O (процесс восстановления; S2O32- – окислитель);
® 2S + 3H2O (процесс восстановления; S2O32- – окислитель);
2S2O32- + S2O32- + 4H+ ® 2SO2 + 2S + 2H2O.
Расставим полученные коэффициенты:
2Na2S2O3 + 2H2SO4 ® 2Na2SO4 + 2SO2 + 2S + 2H2O.
Перед всеми веществами стоит коэффициент 2, его можно сократить:
Na2S2O3 + H2SO4 ® Na2SO4 + SO2 + S + H2O.
б) PCl5 ® PCl3 + Cl2.
Расставим степени окисления всех элементов:
P+5Cl5- ® P+3Cl3- + Cl20.
Фосфор в степени окисления +5 является окислителем, изменяя степень окисления до +3, хлор в степени окисления -1 является восстановителем, изменяя степень окисления до 0. Покажем переход электронов:
2Cl- - 2  ® Cl20 (процесс окисления; Cl- – восстановитель);
® Cl20 (процесс окисления; Cl- – восстановитель);
P+5 +2  ® P+3 (процесс восстановления; P+5 – окислитель);
® P+3 (процесс восстановления; P+5 – окислитель);
2Cl- + P+5 ® Cl2 + P+3.
Расставим полученные коэффициенты:
PCl5 ® PCl3 + Cl2.
Пример 7.
Укажите, как повлияет уменьшение давления на равновесие в реакциях:
а) N2O4 (г) ⇄ 2NO2 (г);
б) 2NO (г) + О2 ⇄ 2NO2 (г);
в) 3Fe2O3 (к) + СО (г) ⇄ 2Fe3O4 (к) + СО2 (г).
Решение:
Согласно принципу Ле Шателье: если на систему, находящуюся в равновесии, оказать внешнее воздействие, то в результате протекающих в ней процессов положение равновесия смещается в сторону, ослабляющее это воздействие, при уменьшении давления равновесие в обратимом процессе смещается в сторону увеличения давления.
а) N2O4 (г) ⇄ 2NO2 (г),
процесс протекает с увеличением объема (1 < 2), т.е увеличением давления, поэтому равновесие смещается в сторону продуктов реакции.
б) 2NO (г) + О2 (г) ⇄ 2NO2 (г),
процесс протекает с уменьшением объема (3 > 2), т.е увеличением давления, поэтому равновесие смещается в исходных веществ.
в) 3Fe2O3 (к) + СО (г) ⇄ 2Fe3O4 (к) + СО2 (г),
процесс протекает без изменения объема, уменьшение давления не оказывает влияния на состояние равновесия.
Пример 8.
Объясните, почему нельзя тушить воспламенившийся металлический кальций водой. Напишите уравнения реакций.
Решение:
Металлический кальций реагирует с водой, поэтому добавление воды к горящему кальцию только усилит процесс. Запишем уравнение реакции взаимодействия кальция с водой:
Ca + 2H2O = Ca(OH)2 + H2.
Пример 9.
Напишите уравнения реакций в молекулярной и ионной форме, при помощи которых можно осуществить следующие превращения: Cl- ® Сl2 ® Cl- ® AgCl.
Решение:
1. Взаимодействие оксида марганца (IV) с концентрированной соляной кислотой:
молекулярная форма:
4HCl + MnO2 = MnCl2 + Cl2 + 2H2O,
ионная форма
4H+ + 2Cl- + MnO2 = Mn2+ + Cl2 + 2H2O.
Электролиз расправа хлорида натрия:
молекулярная форма:
молекулярная форма:
2NaCl  2Na + Cl2,
2Na + Cl2,
ионная форма
2Na+ + 2Cl-  2Na + Cl2.
2Na + Cl2.
2. Взаимодействие хлора с раствором бромида натрия:
молекулярная форма:
Cl2 + 2NaBr = 2NaCl + Br2,
ионная форма:
Cl2 + 2Br- = 2Cl- + Br2.
Взаимодействие металлического натрия и газообразного хлора:
молекулярная форма:
2Na + Cl2 = 2NaCl.
3. Взаимодействие раствора хлорида натрия с раствором нитрата серебра:
NaCl + AgNO3 = AgCl + NaNO3,
ионная форма:
Cl- + Ag+ = AgCl.
Пример 10.
Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
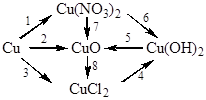
Решение:
1. Взаимодействие меди с разбавленной азотной кислотой:
Cu + 6HNO3 = Cu(NO3)2 + 4NO + H2O.
2. Окисление меди кислородом:
2Cu + O2 = 2CuO.
3. Взаимодействие меди с концентрированной соляной кислотой в присутствии кислорода:
2Cu + O2 + 4HCl = 2CuCl2 + 2H2O.
4. Взаимодействие раствора хлорида меди (II) с раствором гидроксида натрия:
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl.
5. Термическое разложение гидроксида меди (II):
Cu(OH)2 = CuO + H2O.
6. Взаимодействие нитрата меди (II) с раствором гидроксида натрия:
Cu(NO3)2 + 2NaOH = Cu(OH)2 + 2NaNO3.
7. Термическое разложение нитрата меди (II):
2Cu(NO3)2 = 2CuO + 4NO2 + O2.
8. Взаимодействие оксида меди (II) с соляной кислотой:
CuO + 2HCl = CuCl2 + H2O.
|
из
5.00
|
Обсуждение в статье: Задачи для самостоятельного решения |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

