 |
Главная |
Задачи для самостоятельного решения
|
из
5.00
|
Вариант 1
1. Назовите по номенклатуре ИЮПАК каждое из следующих соединений:


2. Укажите из перечисленных ниже соединений те, которые при полимеризации дадут каучук: этаналь, этилен, бутен-2, дивинил, бензол, изопрен. Запишите структурные формулы всех соединений.
3. Закончите уравнения следующих реакций и укажите, какие из них идут по радикальному механизму, а какие – по ионному:
а) С2Н4 + Br2 ®
б) н-С3Н6 + HCl ®
в) н-С4Н10 + Cl2®
г) C3H8 + H2SO4 (разб.) ®
4. Напишите уравнения реакций, показывающих последовательное превращение веществ от известняка, воды и угля до уксусной кислоты.
5. При использовании керогаза в комнате появляется сырость. Определите массу водяных паров и углекислого газа, если в керогазе сгорит 300 г керосина, содержащего: 86 % углерода и 14 % водорода.
6. 5,28 г смеси бутана и 2-бутена обесцветили 32 г 10 %-ного по массе раствора брома. Определите массу бутана, содержащегося в смеси.
Вариант 2
1. Назовите по номенклатуре ИЮПАК каждое из следующих соединений:


2. Укажите среди перечисленных соединений вещества, которые обесцвечивают бромную воду: этилен, этан, дивинил, метилацетилен, пентан. Запишите структурные формулы всех соединений.
3. Закончите уравнения следующих реакций и укажите, какие из них идут по радикальному механизму, а какие по ионному:
а) С3Н6 + Н2О®
б) С2Н2 + Cl2 ®
в) C2H6 + HNO3 (разб)®
г) С3Н8 + Br2 ®
4. Напишите уравнения реакций, показывающие последовательное превращение веществ из метана, брома, натрия в бутен-1.
5. Циклохлоргексан С6Н6Сl6 применяется как ядохимикат в борьбе с вредными насекомыми. Определите объем ацетилена, пошедшего на получение 10 кг циклохлоргексана, по следующим реакциям:
3С2Н2 = С6Н6
С6Н6 +3Cl2 = С6Н6Сl6
6. Определите объем водорода (условия нормальные), выделившегося при каталитическом дегидрировании 2,45 г 2-метилгексана в 2-метилгексен-3, если реакция протекает с выходом 75 % от теоретического.
Вариант 3
1. Назовите по номенклатуре ИЮПАК каждое из следующих соединений:


2. Укажите отличие реакции хлорирования пропана от реакции хлорирования пропилена. Приведите механизмы реакций.
3. Закончите уравнения следующих реакций и укажите, какие из них идут по радикальному механизму, а какие по ионному:
а) С2Н2 + Н2О 
б) С2Н6 + Br2 ®
в) н-С3Н6 +HBr ®
4. Напишите уравнения реакций, показывающие последовательное превращение веществ из ацетилена в 1,2 дихлорэтан.
5. Определите объем кислорода и воздуха, который пойдет на полное сгорание саратовского природного газа, имеющего состав: СН4 – 96,6 %; С2Н6 – 1 %; С3Н8 – 0,5 %; N2 – 3,3 %.
6. 4 л смеси этана и этилена при нормальных условиях пропустили через раствор брома в воде, при этом получилось 3,76 г продукта реакции. Определите массовую долю этилена в смеси.
Вариант 4
1. Назовите по номенклатуре ИЮПАК каждое из следующих соединений:


2. Напишите уравнения реакций, показывающих процесс полимеризации двух и трех молекул ацетилена.
3. Закончите уравнения следующих реакций и укажите, какие из них идут по радикальному механизму, а какие по ионному:
а) С2Н4 
б) СН3 - СН = СН2 + Br2 ®
в) С3Н8 + Сl2 ®
г) CH3 - C º CH + H2O ®
4. Напишите уравнения реакций, показывающие последовательное превращение веществ из углерода в 2-бромпропан.
5. Определите объем кислорода, который потребуется для полного сжигания 13 кг ацетилена.
6. При сжигании 14 мл газа было получено 42 мл углекислого газа и 33,75 мл воды (плотность воды при нормальных условиях равна » 1 г/см3). Плотность газа по водороду – 21. Определите его молекулярную формулу.
ЗАДАНИЕ 2
Задание включает материал раздела органической химии «Углеводороды»: строение, изомерия и номенклатура, свойства, получение. Решение расчетных задач предполагает использование основных понятий химии: относительная атомная и молекулярная масса, моль, молярная масса, молярный объем, способы выражения концентраций растворов
Примеры решения задач
Пример 1.
Напишите молекулярные формулы алкана, алкена, алкина и ароматического углеводорода, каждый из которых содержит шесть атомов углерода.
Решение:
алкан: С6Н14 – гексан;
алкен: С6Н12 – гексен;
алкин: С6Н10 – гексин;
ароматический углеводород: С6Н6 – бензол.
Пример 2.
Напишите сокращенную структурную формулу каждого из следующих соединений: хлорпропин; орто-дихлорбензол; 4,4-диметил-1-пентин; 1-трет-бутил-4-метил-бензол.
Решение:
хлорпропин:
СН3 – С º ССl;
орто-дихлорбензол:

4,4-диметил-пентин-1:

1-трет-бутил-4-метил-бензол:

Пример 3.
Смесь бензола и толуола общей массой 23 г обработали горячим нейтральным раствором перманганата калия. Органический слой и осадок отделили от раствора. Масса осадка оказалась равной 13,05 г. Определите массу органического слоя.
Дано:
m (смеси) = 23 г
m (осадка) = 13,05 г
M (C6H5CH3) = 92 г/моль
M (C6H5CООH) = 122 г/моль
M (MnO2) = 87 г/моль
Найти:
m (орг. слоя)
Решение:
С горячим нейтральным раствором перманганата калия реагирует только толуол. В результате взаимодействия образуется бензойная кислота, оксид марганца (IV) и гидроксид калия. Органический слой составляют образовавшаяся бензойная кислота и не вступивший в реакцию бензол. В осадке – оксид марганца (IV).
Запишем уравнение реакции взаимодействия толуола с раствором перманганата калия:
C6H5CH3 + 2KMnO4 = C6H5CООH + 2MnO2 + 2KOH.
Вычислим количество вещества оксида марганца (IV), образовавшегося в результате взаимодействия:
 (моль).
(моль).
По уравнению реакции соотношение n (C6H5CH3) : n (MnO2) равно 1 : 2, следовательно, в реакцию вступило 0,075 моль толуола. Вычислим его массу:
m (C6H5CH3) = n × M = 0,075 × 92 = 6,9 (г), тогда бензола в смеси было:
m (C6H6) = m (смеси) - m (C6H5CH3) = 23 - 6,9 = 16,1 (г).
По уравнению реакции соотношение n (C6H5COOH) : n (MnO2) равно 1 : 2, следовательно, образовалось 0,075 моль бензойной кислоты. Вычислим её массу:
m (C6H5CООH) = n × M = 0,075 × 122 = 9,15 (г).
Масса органического слоя равна:
m (орг. слоя) = m (C6H6) + m (C6H5CООH) = 16,1 + 9,15 = 25,25 (г).
Ответ: m (орг. слоя) = 25,25 г.
Пример 4.
Через бромную воду массой 120 г пропустили ацетилен объемом 4 л (н. у.) до полного обесцвечивания раствора. Определите массовую долю (%) брома в растворе.
Дано:
m (бромной воды) = 120 г
V (C2H2) = 4 л
M (Br2) = 160 г/моль
Найти:
w (Br2)
Решение:
Запишем уравнение реакции взаимодействия брома с ацетиленом:
Br2 + C2H2 = C2H2Br2
Вычислим количество вещества ацетилен, вступившего в реакцию:
 (моль).
(моль).
По уравнению реакции соотношение n (Br2) : n (C2H2) равно 1 : 1, поэтому n (Br2) = 0,178 моль. Вычислим массу брома:
m (Br2) = n × M = 0,178 × 160 = 28,57 (г).
Вычислим массовую долю брома в растворе:
 (%).
(%).
Ответ: w (Br2) = 23,8 %.
Пример 5.
Напишите уравнения реакций, с помощью которых можно отличить пентан от пентена-1 и пентина-1.
Решение:
Прибавим к веществам бромную воду:
C5H12 + Br2 ® реакция не протекает, бромная вода не обесцвечивается.
C5H10 + Br2 = C5H10Br2 – бромная вода обесцвечивается.
C5H8 + Br2 = C5H8Br2 – бромная вода обесцвечивается, реакция протекает быстрее, чем с пентеном-1.
Пример 6.
Крокодил Гена с друзьями строил дом. У них была бочка с 50 кг карбида кальция для сварки. Шапокляк решила навредить им и налила в бочку ½ ведра воды, вмещающего 10 л воды. Определите, сумела ли Шапокляк испортить весь карбид кальция и можно ли ей закурить сигарету, если бочка стояла в комнате длиной 3 м, шириной 6 м и высотой 2 м. Минимальная взрывоопасная концентрация ацетилена в воздухе 3 % (об.).
Дано:
m (CaC2) = 50 кг
V (H2O) = 5 л
V (комнаты) = 3 × 6 × 2 = 36 м3
jвзр. (С2Н2) = 3 %
М (СаС2) = 64 г/моль
М (Н2О) = 18 г/моль
Найти:
j (С2Н2)
mост.(CaC2)
Решение:
Запишем уравнение реакции взаимодействия карбида кальция с водой:
CaC2 + 2H2O = C2H2 + Ca(OH)2.
Вычислим количество вещества вода, вступившего в реакцию. По условию задачи в бочку налили полведра воды (объем ведра 10 л), т.е. воды взято 5 л или 5000 мл, учитывая, что плотность воды равна 1 г/мл, воды было 5000 г. Тогда:
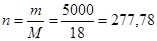 (моль).
(моль).
По уравнению реакции соотношение n (CaC2) : n (H2O) равно 1 : 2, поэтому n (CaC2) равно 138,89 моль. Определим его массу:
m (CaC2) = n × M = 138,89 × 64 = 8888,96 (г) или 8,89 кг, тогда масса оставшегося карбида составляет:
mост. (CaC2) = mисх (CaC2) - mпрор. (CaC2)= 50 - 8,89 = 41,11 (кг).
Весь карбид Шапокляк испортить не удалось.
Вычислим объем выделившегося ацетилена. По уравнению реакции соотношение n (CaC2) : n (С2H2) равно 1 : 1, поэтому n (C2Н2) равно 138,89 моль. Определим его объем:
V (C2H2) = n × Vm = 138,89 × 22,4 = 3111,14 (л) или 3,11 м3, тогда объемная доля ацетилена в воздухе равна:
 (%).
(%).
Концентрация ацетилена в воздухе значительно превышает взрывоопасную (8,64 > 3), курить нельзя.
Ответ: j (С2Н2) = 8,64 %; mост.(CaC2) = 41,11 кг.
|
из
5.00
|
Обсуждение в статье: Задачи для самостоятельного решения |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

