 |
Главная |
Задачи для самостоятельного решения
|
из
5.00
|
Вариант 1
1. Напишите уравнения реакций, показывающие свойства гидроксида алюминия.
2. Покажите, как при помощи одного реагента определить, в какой из склянок находятся сухие соли: хлорид натрия, карбонат натрия, сульфид натрия. Напишите уравнения соответствующих реакций.
3. Получите основной карбонат меди из металлической меди, используя возможно меньшее число реактивов. Запишите уравнения соответствующих реакций.
4. Для нейтрализации 10,0 г раствора, содержащего смесь хлороводородной и бромоводородной кислот, потребовалось 2,5 г 3,2 %-ного раствора NaOH, а при действии на раствор той же массы раствором нитрата серебра выпало 0,3315 г осадка. Определите массовые доли (%) кислот в исходном растворе.
5. Напишите уравнения взаимодействия гидроксида железа (III) с концентрированной соляной и разбавленными серной и азотной кислотами.
6. Вычислите, какое количество технического цинка, содержащего 96 % цинка и 27,5 %-ного раствора HCl должно быть израсходовано для получения 1 т 45 %-ного раствора хлорида цинка.
7. Укажите, какой элемент окисляется и какой восстанавливается в следующих реакциях: а) NH3 + O2 ® N2 + H2O; б) KI + Cu(NO3)2 ® CuI + I2 + KNO3. Расставьте коэффициенты, укажите переход электронов.
8. В одном колхозе под коноплю было внесено на каждый гектар: фосфорных удобрений – 60 кг (в пересчете на Р2О5), калийных удобрений – 150 кг (в пересчете на К2О) и медного купороса – 10 кг. Считая, для простоты, что последний не содержит примесей, укажите, сколько молей каждого из остальных оксидов приходится на 1 моль оксида меди (II).
9. Укажите, как надо изменить температуру и давление (увеличить или уменьшить), чтобы равновесие в реакции разложения карбоната кальция: CaCO3 (к) ⇄ CaO (к) + СО2 (г) - 178 кДж сместить в сторону продуктов разложения.
10. Объясните, почему растворы гидроксидов натрия и калия разрушают стеклянную посуду, особенно при длительном кипячении. Напишите уравнения реакций.
11. Напишите уравнения реакций в молекулярной и ионной формах, при помощи которых можно осуществить следующие превращения: CO32- ® CaCO3 ® Ca2+ ® CaSO4.
12. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
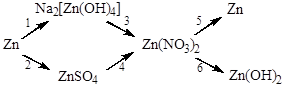
Вариант 2
1. Напишите уравнения взаимодействия разбавленной и концентрированной серной кислоты: а) с медью; б) с цинком; в) со свинцом.
2. Покажите, с помощью каких реакций можно различить растворы серной, азотной и соляной кислот. Напишите уравнения соответствующих реакций.
3. Вам выданы вещества: нитрат кальция, серная кислота, едкий натр, карбонат калия. Как, пользуясь только этими реактивами, получить нитрат натрия двумя способами? Запишите уравнения соответствующих реакций.
4. Сера и алюминий, содержащиеся в смеси, взаимодействовали между собой. Продукт реакции обработали горячей водой. Часть выделившегося газа пропустили через хлорную воду, отделили выпавший осадок, а к раствору добавили избыток нитрата серебра. Образовалось 8,61 г белого творожистого осадка. Другую часть газа пропустили через 145 мл 10 %-ного раствора сульфата меди (плотность 1,1 г/мл), в результате чего концентрация сульфата меди в растворе стала равной 6,09 %. Рассчитайте массу серы, вступившей в реакцию. Напишите уравнения всех реакций.
5. Укажите, какие известны «извести». Напишите их химический состав и уравнения получения.
6. Вычислите, сколько грамм хрома можно получить при взаимодействии оксида хрома (III) с кремнием, масса которого 10 г. Выход продукта 90 %.
7. Определите степени окисления каждого элемента и расставьте коэффициенты в следующих схемах: а) Fe + FeI3 ® FeI2; б) H2S + I2 + H2O ® H2SO4 + HI.
8. В одном колхозе внесли под яровую пшеницу удобрения из расчета: аммиачной селитры – 150 кг, суперфосфата (содержащего 30 % усвояемого Р2О5) – 300 кг и хлорида калия – 100 кг на гектар. Вычислите, сколько это составляет в пересчете на азот, дигидрофосфат кальция и оксид калия.
9. Укажите, как повлияет увеличение давления на равновесие в системах: а) SO2 (г) + Cl2 (г) ⇄ SO2Cl2 (г); б) Н2 (г) + Br2 (г) ⇄ 2HBr (г).
10. Покажите, как химическим путем удалить с алюминиевого изделия продукты коррозии (оксид и гидроксид алюминия), не причиняя ущерба металлу. Напишите уравнения реакций.
11. Покажите, какие из смесей: а) оксида и гидроксида металла; б) металла и оксида металла – дают при взаимодействии с водой раствор только одного вещества. Приведите примеры, напишите уравнения реакций.
12. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
Ca ® Ca(OH)2 ® CaCO3 ® CaO ® Ca(OH)2 ® CaCl2 ® Ca.
Вариант 3
1. Напишите ионные уравнения реакций обмена, если:
- одно из образующихся веществ мало диссоциирует на ионы, второе нерастворимо;
- одно из образующихся веществ растворимо, второе нет;
- реакция обратима;
- одно из образующихся веществ растворимо, второе выделяется в виде летучего вещества.
2. В трех пробирках находятся сухие вещества: оксид кальция, оксид алюминия, оксид фосфора. Покажите, с помощью каких реагентов можно различить эти вещества. Напишите уравнения реакций.
3. Выданы концентрированная соляная кислота, вода, диоксид марганца, медь и цинк в виде тонких проволок. Как, используя эти вещества, получить хлорид цинка и хлорид меди (II) в виде кристаллогидратов? Опишите ход выполнения работы, составьте уравнения химических реакций, укажите условия их протекания.
4. При сжигании 0,896 л (н. у.) смеси СО и СО2 в избытке кислорода было израсходовано 0,112 л кислорода, образовавшаяся газовая смесь пропущена через раствор, содержащий 2,96 г гашеной извести. Определите состав исходной газовой смеси (в % по объему), а также состав и массу образовавшегося осадка.
5. Покажите, как могут быть получены гидроксиды щелочноземельных металлов. Гидроксид какого элемента является наиболее сильной щелочью? Укажите, какие технические названия носят гидроксиды кальция и бария.
6. При промышленном получении медного купороса медный лом окисляется при нагревании кислородом воздуха и полученный оксид меди (II) растворяется в серной кислоте. Вычислите расход меди и 80 %-ной H2SO4 на 1 т CuSO4 × 5H2O, если выход продукта 75 %.
7. Напишите уравнения реакций: а) йодида магния с бромом; б) магния с раствором бромоводородной кислоты. Укажите, какой элемент в каждом случае является окислителем и какой восстановителем, покажите переход электронов.
8. В одном колхозе внесли под картофель, помимо навоза, следующие массы минеральных удобрений на гектар: гранулированного суперфосфата, содержащего 12,5 % усвояемого P2O5 – 0,15 т, аммиачной селитры – 0,1 т и хлорида калия, содержащего 90 % KCl – 0,1 т. Пересчитайте, каким массам гидрофосфата кальция, азота и оксида калия это соответствует.
9. Реакция протекает по уравнению: 2SO2 (г) + O2 (г) ⇄ 2SO3 (ж) + 284,2 кДж. Изменением каких параметров можно добиться смещения равновесия в сторону образования оксида серы (VI)?
10. Напишите уравнения всех реакций, которые могут протекать при хранении металлических лития и натрия на воздухе.
11. Сохранятся ли ионы натрия: а) при взаимодействии гидроксида натрия с соляной кислотой; б) при взаимодействии гидроксида натрия с хлоридом меди (II). Напишите уравнения соответствующих реакций.
12. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
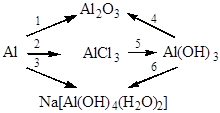
Вариант 4
1. Объясните, как диссоциируют на ионы водные растворы амфотерных оснований. Приведите примеры таких оснований и покажите диссоциацию их на ионы.
2. Укажите, при помощи какого одного реагента можно распознать растворы трех веществ: хлорида калия, хлорида алюминия и хлорида магния.
3. В лаборатории имеются железо, соляная кислота, едкий натр, карбонат кальция, оксид меди (II). Можно ли получить 12 новых неорганических веществ, если использовать эти реактивы и продукты их взаимодействия в качестве исходных? Напишите уравнения соответствующих реакций.
4. Имеется смесь азота и водорода. Азот получен термическим разложением 12,8 г нитрита аммония, водород – «растворением» 19,5 г цинка в избытке разбавленной серной кислоты. В соответствующих условиях газы прореагировали, а затем их пропустили через 100 мл 32 %-ного раствора серной кислоты (плотность 1,22 г/мл). Определите, какой газ оказался в избытке и какова массовая доля (%) соли в растворе. Считать, что все реакции проходят с выходом 100 %.
5. Укажите, какой состав имеют «сода каустическая», «сода кристаллическая», «сода кальцинированная», «сода питьевая». Запишите уравнения реакций их получения.
6. Вычислите, сколько меди (в г) получится из 500 г халькопирита CuFeS2 при его взаимодействии с оксидом кремния (IV) в атмосфере кислорода. Выход продукта 75 %.
7. Укажите, какой элемент окисляется и какой восстанавливается в следующих реакциях: а) MnS + HNO3 (конц.) ® MnSO4 + NO2 + H2O; б) Al + V2O5 ® V + Al2O3. Расставьте коэффициенты, укажите переход электронов.
8. Объясните, почему нитрат калия называют безбалластным удобрением. Вычислите содержание в нем питательных элементов.
9. При определенных условиях реакция хлороводорода с кислородом является обратимой: 4HCl (г) + O2 (г) ⇄ 2Cl2 (г) + 2Н2О (г) + 116,4 кДж. Покажите, какое влияние на равновесное состояние системы окажут: а) увеличение давления; б) повышение температуры; в) введение катализатора.
10. Объясните, на чем основано применение нагретого кальция для очистки аргона от примеси кислорода и азота. Напишите уравнения реакций.
11. Приведите примеры реакций, при которых происходят процессы, выраженные следующими схемами: а) Al0 ® Al3+; б) Al3+ + OH- ® Al(OH)3.
12. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
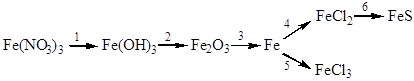
|
из
5.00
|
Обсуждение в статье: Задачи для самостоятельного решения |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

