 |
Главная |
Задачи для самостоятельного решения
|
из
5.00
|
Вариант 1
1. Элементы А, В и С принадлежат к тому же периоду периодической системы химических элементов, что и самый распространенный в земной коре элемент. Формальная положительная и отрицательная степени окисления элемента А имеют одинаковую величину. Элемент В – неметалл и образует с элементом А соединение, в котором на один атом элемента А приходится два атома элемента В. Элемент С образует с элементом В соединение ВС. О каких элементах идет речь? Напишите формулу соединения, в которое входят все три элемента, предскажите его растворимость в воде и напишите уравнения двух – трех реакций, в которые оно вступает.
2. Некоторое вещество, обладающее металлическим блеском и плавящееся при легком нагревании, окрашивает пламя в малиновый цвет. 5,75 г этого вещества при осторожном растворении в воде выделили 2,8 л газа (н. у.). Что представляет собой неизвестное вещество? Какое количество и какого осадка может выпасть при добавлении к образовавшемуся раствору при кипячении избытка раствора медного купороса?
3. В пять пробирок налиты разбавленные растворы хлорида железа (III), хлорида аммония, нитрата меди (II), сульфата железа (II), хлорида алюминия. Как с помощью одного химического реактива определить эти вещества?
4. Навеску оксида металла массой 2,32 г обработали раствором соляной кислоты. Полученный осадок отфильтровали, растворили в аммиаке, к раствору добавили избыток глюкозы и прокипятили. Выделившийся металл отфильтровали, высушили и взвесили; его масса оказалась равной 2,16 г. Определите металл и напишите уравнения описанных реакций.
5. Определите массу раствора гидроксида натрия (w(NaOH) = 40 %), необходимую для нейтрализации раствора, в котором содержится 1 моль ортофосфорной кислоты, 3 моль уксусной, 2 моль соляной и 1 моль серной.
6. Приведите пример соли, при взаимодействии которой с соляной кислотой, образуется осадок гидроксида металла. Запишите уравнения соответствующих реакций.
7. Предложите способ разделения смеси фенола, анилина, уксусной кислоты и нитробензола. Напишите уравнения реакций.
8. Для нейтрализации 10 г спиртового раствора смеси анилина и фенола потребовалось 49,02 мл 2,24 %-ного раствора едкого кали (r = 1,02 г/см3), а при добавлении к 5 г того же раствора избытка бромной воды получено 8,25 г осадка. Найдите концентрацию анилина и фенола в исходном растворе (в процентах по массе).
9. Напишите структурные формулы всех соединений, имеющих состав С5Н10О. Какие из них, по вашему мнению, не могут существовать?
10. Смесь трех газов с плотностью по водороду 15,7 пропустили через раствор серной кислоты, при этом ее объем уменьшился на 20 %, а плотность стала 17,5. Полученную смесь пропустили через раствор гидроксида натрия, при этом ее объем уменьшился на 25 %, а плотность оставшегося газа стала равной 16. Определите качественный и количественный составы исходной смеси.
Вариант 2
1. Три элемента А, В, С находятся в одном ряду периодической системы и образуют соединения А2В и АС, которые при взаимодействии с соляной кислотой дают газообразные вещества, одно из которых самовоспламеняется, а другое может гореть на воздухе. Соединение А с хлором растворимо в воде, причем его раствор обладает слегка кислой реакцией; соединение В с хлором бурно реагирует с водой, а С образует с хлором несколько соединений, обладающих неприятным запахом. Какие это элементы? Как получают и где применяют их оксиды?
2. Образец сплава двух металлов массой 10,65 г при обработке 800 мл 3 моль/л раствора едкого натра образует 2,24 л водорода и черный порошок, самовоспламеняющийся на воздухе и являющийся активным катализатором гидрирования олефинов. То же количество сплава полностью растворяется в избытке соляной кислоты с выделением 5,6 л водорода (для газов условия нормальные). Из каких металлов состоит сплав?
3. Каким образом, имея только воду, можно различить следующие твердые вещества: сульфат бария, сульфат натрия, сульфат меди, сульфат алюминия, гидроксид натрия? Опишите, по каким признакам и в какой последовательности вы будете определять вещества. Напишите уравнения реакций.
4. Навеску соли массой 19,73 г прокалили. Выделившийся бесцветный газ полностью поглотили раствором щелочи, а остаток растворили в соляной кислоте. Из половины раствора выделили 10,41 г соли, а при добавлении серной кислоты к оставшемуся раствору получили белый осадок массой 11,67 г. Определите формулу соли и напишите уравнения происшедших реакций.
5. При сплавлении со щелочью смеси металла с его оксидом массой 8,57 г выделилось 2,24 л водорода (н. у.). Сплав растворили в воде, к раствору добавили соляную кислоту до нейтральной реакции среды. Выпавший осадок отфильтровали и растворили в азотной кислоте; после выпаривания этого раствора досуха из него выделили соль массой 23,66 г. Определите качественный и количественный составы смеси и напишите уравнения описанных реакций.
6. Можно ли приготовить путем осаждения из раствора сульфид алюминия? Ответ поясните уравнениями соответствующих реакций.
7. В цилиндре имеется смесь газов: бутана, бутадиена, ацетилена и аммиака. Какими реагентами надо подействовать на эту смесь, чтобы последовательно удалить один газ за другим? Напишите уравнения возможных химических реакций.
8. Для нейтрализации 125 г свежеприготовленной смеси этилового спирта с уксусной кислотой в гексане потребовалось 76,92 мл 5 %-ного раствора едкого натра (r = 1,04 г/см3), а при действии на то же количество раствора избытка натрия выделилось 3,36 л газа (условия нормальные). Определите содержание (в процентах по массе) этилового спирта в исходном растворе.
9. В природе встречаются вещества, имеющие состав С2Н2О6Са и СН2О5Cu2. Напишите их структурные формулы и расскажите об этих соединениях.
10. Определите объемную долю (%) водорода, кислорода и азота в смеси, если известно, что 89,6 л (н. у.) имеют массу 49 г, а после поджигания этой массы смеси и удаления паров воды объем остатка составил 56,0 л (н. у.).
Вариант 3
1. Элементы А, В и С находятся соответственно в I, II и III периодах периодической системы химических элементов Д.И. Менделеева. Они взаимодействуют друг с другом, образуя соединения АС, А2В и В2С2. Соединения АС и В2С2 реагируют с А2В, образуя щелочной раствор и два газа, реакция между которыми происходит при пропускании электрического разряда и приводит к одному из исходных соединений. Укажите, какие это элементы, напишите уравнения реакций.
2. Смесь двух металлов, находящихся в двух различных группах периодической системы, полностью реагирует при нагревании с 56 см3 водорода (н. у.) и дает смесь двух ионных соединений. При растворении этой смеси в 270 мг воды происходит количественная реакция, в которой расходуется 1/3 количества воды. В результате реакции получается щелочной раствор 30,77 %-ной концентрации и отделяется в виде осадка только одно твердое вещество, масса которого равна 58,2 % от массы веществ, образовавшихся при второй реакции. Это полученное твердое вещество при обжиге теряет 27 мг своей массы. Если смесь, полученную при действии воды, обработать стехиометрическим количеством карбоната аммония, то концентрация растворенного вещества составит 34 %, а если провести ту же реакцию с щелочным раствором, не содержащим осадка, то концентрация растворенного вещества будет 38 % (предполагается, что образующиеся осадки и газы полностью удаляются из растворов). Определите массу и состав исходной смеси металлов.
3. В пронумерованных пробирках (1–5) находятся водные растворы Na2CO3, Na2SO4, Ba(NO3)2, Pb(NO3)2 и CaCl2. Определите, какие вещества находятся в пронумерованных пробирках, если при попарном сливании растворов было установлено следующее: 1) раствор 2 дает белые осадки с растворами 1, 3 и медленно – с 4; 2) раствор 5 дает белые осадки с растворами 1, 3 и 4; 3) раствор 3 медленно дает осадок с раствором 4; 4) раствор 1 не образует осадков с растворами 3 и 4.
4. Для анализа железной руды, содержащей FeO и Fe2O3, два образца массой 0,1000 г растворили в соляной кислоте. Растворы обработали хлоридом олова (II), избыток которого удалили хлоридом ртути (II). В первом растворе на окисление ионов Fe2+ израсходовали 12,50 мл раствора перманганата калия, содержащего 3,1600 г KMnO4 в 1 л раствора, во втором – также 12,50 мл раствора дихромата калия, содержащего 4,9023 г K2Cr2O7 в 1 л раствора. Напишите уравнения проведенных реакций и вычислите массовую долю (%) железа в руде.
5. Смесь некоторого металла, степень окисления которого во всех его соединениях равна +2, с его оксидом массой 0,3 г полностью растворили в 8 мл 1 моль/л соляной кислоты. При этом выделилось 36,4 мл водорода (н. у.). Вычислите массовую долю металла и оксида (%) и назовите исследуемый металл.
6. Можно ли приготовить путем осаждения из раствора карбонат железа (III)? Ответ поясните уравнениями соответствующих реакций.
7. Имеется смесь уксусного альдегида, уксусной кислоты и бензола. Как обнаружить наличие каждого из этих веществ в данной смеси? Напишите уравнения реакций.
8. При взаимодействии 25 мл бензольного раствора 3,66 г свежеприготовленной смеси фенола, этилового спирта и уксусной кислоты неизвестного состава с избытком металлического натрия выделилось 672 мл газа (н. у.). Для полной нейтрализации того же количества смеси необходимо 18,18 мл 8 %-ного раствора едкого натра (плотность равно 1,1 г/см3), а добавление бромной воды к полученному при нейтрализации раствору приводит к выделению 3,31 г осадка. Найдите концентрацию каждого из растворенных веществ (в моль/л) в исходном бензольном растворе.
9. Напишите структурные формулы всех изомеров, имеющих состав С3Н6О. К каким классам они будут относиться? Предскажите важнейшие реакции этих изомеров.
10. В сосуде, полностью заполненном бутаном, проводят дегидрирование, в результате чего получают смесь бутана, водорода, бутенов и бутадиена. Равновесие устанавливается при степени дегидрирования – 0,1; причем отношение парциальных (относительных) давлений газообразных бутенов и дивинила равно 3. Определите, какое количество бутана было введено в реакцию, если известно, что давление в герметически закрытом сосуде объемом 20 л оказалось равным 253,2 кПа и весь процесс проводили при температуре 400 °С.
Вариант 4
1. Некоторый элемент Х образует более 10 кислот, в том числе кислоты А, В и С. Вещества А и В при совместном нагревании ниже 150 °С образуют как свободный элемент Х в виде простого вещества, так и ангидрид кислоты С, а при более высокой температуре дают только ангидрид кислоты С и воду. Какой это элемент? Реагируют ли между собой вещества А и С? Где применяются названные вещества?
2. Образец смеси двух твердых простых веществ массой 1,52 г обработан избытком 10 %-ной соляной кислоты, при этом было получено 0,896 л газа и осталось 0,56 г остатка, нерастворимого в избытке кислоты. Во втором опыте 1,52 г той же смеси обработали избытком 10 %-ного раствора едкого натра, при этом выделилось также 0,896 л газа и осталось 0,96 г вещества, нерастворимого в избытке раствора щелочи. В третьем опыте такое же количество исходной смеси прокалили без доступа воздуха при высокой температуре и получили индивидуальное вещество, которое полностью растворяется в соляной кислоте с выделением 0,448 л некоторого газа. Введение всего полученного газа А в однолитровый герметический сосуд, наполненный кислородом, привело к понижению давления внутри сосуда примерно в 10 раз. Напишите уравнения всех описанных реакций и докажите их расчетом. (Условия для газов считать нормальными, атомные массы округлять до целочисленных значений).
3. Химик получил образцы трех металлов серебристо-белого цвета и нашел способ, как их быстро различить. Для этого он подверг образцы действию кислот и раствора гидроксида натрия. Результаты его исследования представлены ниже («+» – реакция идет; «-» – металл не реагирует).
| Реактив | HCl (конц.) | HNO3 (конц.) | NaOH |
| Металл I | - | + | - |
| Металл II | + | - | + |
| Металл III | + | + | + |
Определите, какие металлы были исследованы, и напишите уравнения реакций.
4. Получены одинаковые результаты анализа руды. Сырьем для получения серной кислоты являются руды, содержащие пирит FeS2. Для анализа руды на содержание серы были проведены следующие операции. Навеску руды массой 0,5 г спекли с карбонатом натрия и перманганатом калия. Спек обработали раствором соляной кислоты, отфильтровали от осадка и осаждали раствором хлорида бария. После нескольких часов выстаивания осадок отфильтровали, промыли водой, высушили, прокалили до постоянной массы и взвесили. Напишите реакции, которые происходили по ходу анализа. Вычислите массовую долю (%) серы в руде, если масса полученного осадка сульфата бария составила 1,3590 г.
5. Смесь иодида и хлорида калия массой 2,0 г растворили в воде. Через раствор пропустили хлор (в избытке), а остаток прокалили после предварительного выпаривания раствора. Масса полученного таким путем вещества составила 1,634 г. Рассчитайте состав смеси.
6. Напишите основные уравнения реакций, происходящих при производстве карбоната натрия аммиачным методом (метод Сольве), а также в процессе регенерации исходных веществ. Можно ли аналогичным способом получать карбонат калия (поташ)?
7. Напишите схему реакций, с помощью которых можно однозначно доказать строение этилового эфира b-хлормасляной кислоты. Как можно получить это соединение из этилового спирта? Напишите уравнения реакций.
8. Добавлением к природному газу небольших количеств (0,001 % по объему) изоамилмеркаптана C5H11SH пользуются для обнаружения утечки газа в жилых помещениях. Определите, к какому объему природного газа был добавлен меркаптан, если известно, что такая же навеска меркаптана была прибавлена к 50 мл 0,01 моль/л раствора йода в растворе йодида калия, в результате чего образовался дисульфид C5H11SSC5H11, а на титрование избыточного количества йода потребовалось 30 мл 0,01 моль/л раствора тиосульфата натрия. Уравнения реакций:
а) 2RSH + I2 = RSSR + 2HI,
б) I2 + 2Na2S2O3 = 2NaI + Na2S4O6.
9. В соединении С4Н4Сl4 все атомы хлора структурно эквивалентны. Как это понять? Напишите возможные структуры изомеров соединений такого состава.
10. В замкнутом сосуде со свободным от твердых веществ объемом 1 л, наполненного активированным углем, находится ацетилен (условия в пересчете на нормальные). Сосуд нагрет до 300 °С, выдержан некоторое время при этой температуре, а затем охлажден до 0 °С. Давление в сосуде при этом понизилось в пять раз. Полученный при реакции продукт А может реагировать с бромом в присутствии соли железа. Газ, выделившийся при этом, вступает в реакцию с 200 мл 0,04 моль/л баритовой воды. Определите выход вещества А в процентах от теоретически возможного, если считать, что при этом в реакции с бромом образуется только одно органическое соединение, которое имеет плотность паров по гелию, примерно равную 40.
ЗАДАНИЕ 3
Задание включает следующие разделы химии: реакции в растворах, химическое равновесие, простейшие термохимические расчеты, связь между классами органических и неорганических соединений, структурные формулы и пространственное строение веществ.
Примеры решения задач
Пример 1.
При взаимодействии 100 мл раствора неизвестной соли с раствором нитрата серебра выпадает 2,87 г белого осадка, а при действии на то же количество раствора сульфата калия получено 2,33 г белого осадка. Определите состав и концентрацию исходного раствора соли, если известно, что в обоих случаях для полного осаждения потребовалось по 200 мл 0,1 моль/л раствора осадителя.
Дано:
V (AB) = 100 мл
m (осадка)1 = 2,87 г
m (осадка)2 = 2,33 г
V (осадителя) = 200 мл
С (осадителя) = 0,1 н
Найти:
АВ, С (АВ)
Решение:
Нормальным называется раствор, в 1 л которого содержится 1 моль эквивалентов растворенного вещества. Эквивалентом называется такая формульная единица (часть атома, молекулы, иона), которая соединяется с одним атомом водорода, замещает его или равновесная ему. Например, эквивалент H2S равен ½, а молярная масса эквивалента H2S составляет 17 г/моль.
Число молей эквивалентов растворенного вещества, содержащееся в 1 л раствора, называют нормальной концентрацией раствора.
Определим количества осадителей в обоих случаях:
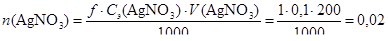 (моль);
(моль);
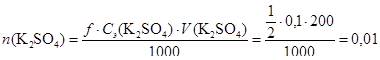 (моль).
(моль).
Запишем схемы протекающих реакций:
AB + AgNO3 → ANO3 + AgB¯;
AB + K2SO4 → ASO4¯ + KB.
Определим молярные массы полученных осадков, исходя из предположения, что
n (AgNO3) = n (AgB) и n (K2SO4) = n (ASO4):
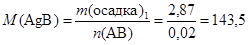 (г/моль);
(г/моль);
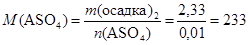 (г/моль).
(г/моль).
Определим M (B) и M (A): M (B) = M (AgB) - M (Ag) = 143,5 - 108 = 35,5 (г/моль). Это атомная масса хлора, следовательно В – Cl;
M (A) = M (ASO4) - M (S) - 4×M (O) = 233 - 32 - 4∙16 = 137 г/моль. Это атомная масса бария, следовательно А – Ba.
Искомое соединение – хлорид бария BaCl2. Запишем уравнения протекающих реакций:
BaCl2 + 2AgNO3 = Ba(NO3)2 + 2AgCl¯;
BaCl2 + K2SO4 = BaSO4¯ + 2KCl, т.е. сделанное предположение верно.
Определим концентрацию исходного раствора:
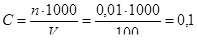 моль/л.
моль/л.
Ответ: BaCl2; C = 0,1 моль/л.
Пример 2.
Металл А при слабом нагревании реагирует с газом В, образуя соединение АВ. Как А, так и АВ энергично реагирует с водой, причем в обоих случаях образуются одни и те же продукты. Металл А можно получить электролизом его расплавленного хлорида, причем 3,86 А×ч электрического тока выделяют 1 г металла А. Найдите А и В и напишите уравнения соответствующих реакций.
Дано:
m (А) = 1 г
I = 3.86 A
t = 1 ч = 3600 с
Найти:
А и В.
Решение:
Воспользуемся законом Фарадея 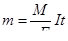 для определения молярной массы металла одновалентного металла (F – постоянная Фарадея, равная 96500 Кл/моль, n – число электронов, участвующих в электродной реакции):
для определения молярной массы металла одновалентного металла (F – постоянная Фарадея, равная 96500 Кл/моль, n – число электронов, участвующих в электродной реакции):
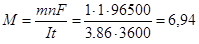 г/моль.
г/моль.
Это атомная масса лития, следовательно, металл А – Li.
Предположим, что В – это водород. Запишем уравнения соответствующих реакций:
2Li + H2 = 2LiH;
2Li + 2H2O = 2LiOH + H2↑;
LiH + H2O = LiOH + H2↑;
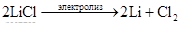 .
.
Сделанное предположение верно, т.к. написанные уравнения реакций удовлетворяют условию задачи.
Ответ: А – Li; B – H2.
Пример 3.
При сжигании 23 г газообразного вещества, плотность которого при 0 °С и давлении 1 атм (101,3 кПа) равна 2,05 г/л, получается 44 г СО2 и 27 г Н2О. Какова структурная формула этого соединения?
Дано:
m = 23 г
t = 0 °C
р = 1 атм = 101,3 кПа
r = 2,05 г/л
m (CO2) = 44 г
m (H2O) = 27 г
M (CO2) = 44 г/моль
M (H2O) = 18 г/моль
Найти:
структурную формулу вещества
Решение:
Определим объем газообразного вещества:
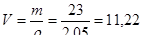 (л).
(л).
Определим количество этого вещества; т.к. объем определен при нормальных условиях, что следует из условия задачи, то
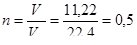 (моль).
(моль).
Молярная масса этого вещества равна 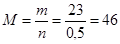 г/моль.
г/моль.
Определим количества воды и углекислого газа:
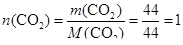 (моль);
(моль);
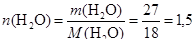 (моль).
(моль).
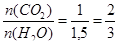 , отсюда следует, что число атомов углерода в газообразном соединении равно 2, а число атомов водорода – 6.
, отсюда следует, что число атомов углерода в газообразном соединении равно 2, а число атомов водорода – 6.
Рассчитаем молярную массу соединения С2Н6: M (C2H6) = 2∙12 + 6∙1 = 30 г/моль – это не соответствует молярной массе газа, рассчитанной из данных задачи (46 г/моль), следовательно, в состав соединения входит еще элемент. Определим молярную массу этого элемента:
M (Э) = М - M (C2H6) = 46 - 30 = 16 г/моль, т. е. этот элемент – кислород.
Искомая формула С2Н6О, структурная – CH3 – O – CH3 – диметиловый эфир.
Ответ: CH3 – O – CH3.
Пример 4.
Напишите реакции, с помощью которых можно осуществить превращения по схеме Mn ® Mn(NO3)2 ® MnO2 ® K2MnO4 ® KMnO4 ® MnO2.
Решение :
1. Взаимодействие марганца с разбавленной азотной кислотой:
3Mn + 8HNO3 = 3Mn(NO3)2 + 2NO + 4H2O.
2. Взаимодействие нитрата марганца с пероксидом водорода в щелочной среде:
Mn(NO3)2 + 2NaOH + H2O2 = MnO2 + 2NaNO3 + 2H2O.
3. Сплавление оксида марганца (IV) с нитратом калия и гидроксидом калия:
MnO2 + KNO3 + 2KOH = K2MnO4 + KNO2 + H2O.
4. Взаимодействие манганата калия с газообразным хлором:
2K2MnO4 + Cl2 = 2KMnO4 + 2KCl.
5. Взаимодействие перманганата калия с сульфитом натрия в нейтральной среде:
2KMnO4 + 3Na2SO3 + H2O = 2MnO2 + 3Na2SO4 + 2KOH.
Пример 5.
При сжигании органического вещества, состоящего только из углерода и водорода, получилось 3,08 мг углекислого газа и 1,44 мг воды. Найдите простейшую формулу вещества.
Дано:
m (CO2) = 3,08 мг
m (H2O) = 1,44 мг
M (CO2) = 44 г/моль
M (H2O) = 18 г/моль
Найти:
СхНy
Решение:
Запишем уравнение реакции горения:
СхНу + (х + 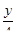 )О2 = хСО2 +
)О2 = хСО2 + 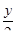 Н2О.
Н2О.
Рассчитаем количества вещества углекислого газа и воды, получившиеся в ходе реакции:
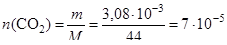 (моль);
(моль);
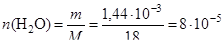 (моль).
(моль).
Определим отношение количества вещества углекислого газа и воды:
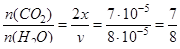 , т.е.
, т.е. 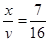 , следовательно, простейшая формула вещества С7Н16.
, следовательно, простейшая формула вещества С7Н16.
Ответ: С7Н16.
Пример 6.
Вычислите равновесные концентрации и константу равновесия для протекающей в газовой фазе реакции Н2 (г) + I2 (г) ⇄ 2HI (г), если известно, что при данных условиях исходные концентрации 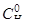 и
и 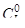 составляли 0,02 моль/л, а равновесная концентрация HI равна 0,03 моль/л.
составляли 0,02 моль/л, а равновесная концентрация HI равна 0,03 моль/л.
Дано:
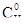 =
= 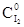 = 0,02 моль/л
= 0,02 моль/л
[HI] = 0,03 моль/л
Найти:
[H2]
[I2]
KC
Решение:
Запишем уравнение реакции и исходные данные:
H2 + I2 ⇄ 2HI
C0 0,02 0,02 0
[C] 0,03
Если в результате реакции образовалось 0,03 моль йодоводорода, то израсходовалось 0,015 моль водорода и йода (0,03 : 2), тогда в момент достижения равновесия концентрация водорода и йода составила:
[H2] = [I2] = 0,02 - 0,015 = 5 × 10-3 (моль/л).
Запишем полученные данные:
H2 + I2 ⇄ 2HI
C0 0,02 0,02 0
[C] 5 × 10-3 5 × 10-3 0,03
убыль 0,015 0,015
Рассчитаем константу равновесия процесса:
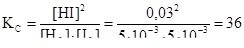
Ответ: [H2] = [I2] = 5∙10-3 моль/л, KC = 36.
Пример 7.
При сгорании 1 моля метана выделяется 892 кДж теплоты. Какую массу оксида ртути можно разложить, используя эту теплоту на 50 %? Известно, что при образовании 1 моля оксида ртути из кислорода и ртути выделяется 90,3 кДж.
Дано:
Q1 = 892 кДж/моль
h = 50 %
Q2 = 90,3 кДж/моль
M (HgO) = 216,59 г/моль
Найти:
m (HgO)
Решение:
Запишем реакции сгорания метана:
СН4 +2О2 = СО2 + 2Н2О + 892 кДж;
и образования оксида ртути:
Hg + ½O2 + HgO + 90,3 кДж.
Рассчитаем количество оксида ртути, которое можно разложить с учетом 50 % использования теплоты первой реакции:
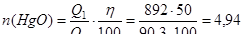 (моль).
(моль).
Тогда m (HgO) = n × M = 4,94 × 216,59 = 1070 (г).
Ответ:m (HgO) = 1070 г.
Пример 8.
Какие химические свойства можно ожидать у известного лекарственного вещества – ацетилсалициловой кислоты (аспирина), имеющей формулу
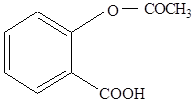
Напишите уравнения реакций, в которые вступает это соединение. Как можно получить это вещество?
Решение:
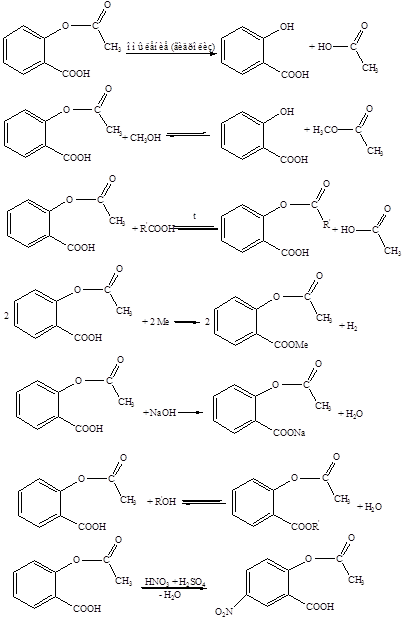
Вещество можно получить из о-крезола:
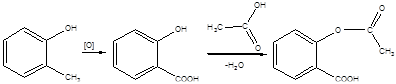
Пример 9.
Расположите по увеличению подвижности атома водорода в функциональной группе следующие соединения: масляный альдегид, масляную кислоту, бутиловый спирт. Сравните подвижность водорода в этих соединениях с подвижностью водорода в бутане и бутинах.
Решение:
| 1 | масляный альдегид | 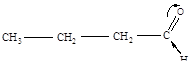
|
| 2 | масляная кислота | 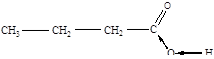
|
| 3 | бутиловый спирт | 
|
| 4 | бутан | 
|
| 5 | бутин | 
|
Из приведенных формул соединений видно, что подвижность атома водорода в функциональной группе возрастает в соединениях в следующем порядке: бутиловый спирт – масляный альдегид – масляная кислота.
В кислородсодержащих соединениях подвижность водорода выше, чем в бутане и бутинах, при чем для бутинов характерны реакции присоединения по тройной связи.
Пример 10.
Напишите структурные формулы всех изомеров, углеводородов, имеющих состав С4Н8. К каким классам они будут относиться? Предскажите важнейшие реакции этих изомеров.
Решение:
| 1 | 
| бутен – 1 |
| 2 | 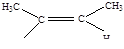
| цис-бутен - 2 |
| 3 | 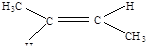
| транс-бутен - 2 |
| 4 | 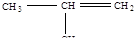
| 2-метилпропен – 1 |
| 5 | 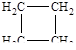
| циклобутан |
| 6 | 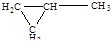
| метилциклопропан |
Приведенные изомеры относятся к классу углеводороды: из них первые четыре – это непредельные углеводороды с двойной связью и последние два – это предельные углеводороды с замкнутой (циклической) цепью.
Для непредельных углеводородов характерны следующие реакции:
1. присоединения
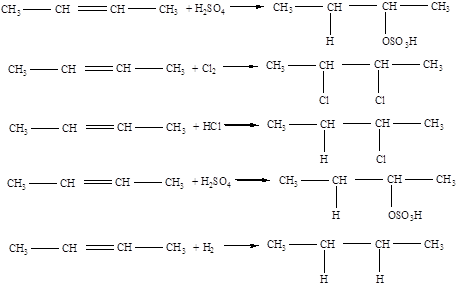
2. окисления
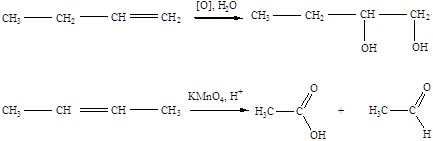
3. полимеризации
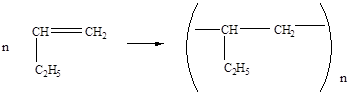
Циклоалканы по химическим свойствам близки к алканам: горючи, химически малоактивны, атомы водорода замещаются галогенами.
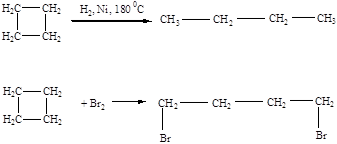
|
из
5.00
|
Обсуждение в статье: Задачи для самостоятельного решения |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

