 |
Главная |
Вопрос №2. Зависимость скорости химической реакции от температуры. Энергия активации
|
из
5.00
|
Для большинства реакций справедливо правило Вант-Гоффа: Повышение температуры на 10К увеличивает скорость большинства реакций в 2-4 раза:
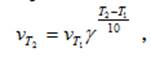
где 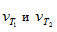 - скорости реакции при Т1 и Т2; γ – термический коэффициент скорости химической реакции
- скорости реакции при Т1 и Т2; γ – термический коэффициент скорости химической реакции
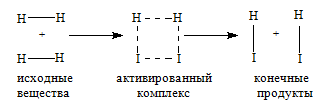
Молекулы газов и жидкостей испытывают ежесекундно огромное число столкновений. Только очень малая доля столкновений заканчивается химическими превращениями. Такие столкновения называются эффективными соударениями. Молекулы - активными молекулами с большей энергией. Избыточная энергия необходима молекулам для преодоления сил отталкивания внешних электронных оболочек и для образования активированного комплекса, т.е. промежуточного соединения между исходными веществами и конечными продуктами. В активированном комплексе старые связи еще не полностью разрушены, а новые еще не полностью образовалис
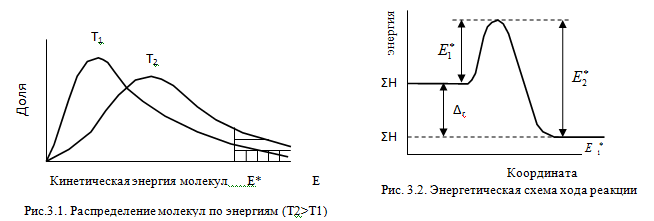
Изменение энергии в ходе химической реакции показано схемой процесса активации (рис.3.2). По оси ординат отложена потенциальная энергия системы. Абсцисса - координата реакции или реакционного пути. В процессе химического превращения переход системы из начального состояния с энергией ΣНi в конечное состояние с ΣНf происходит через энергетический барьер 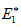 .
.
Энергия активации (Е*) - это энергия, необходимая для перевода в состояние активированного комплекса 1 моль реагирующих веществ. Разность ΣНf - ΣНi составляет тепловой эффект реакции (ΔrH). Для обратной реакции тепловой эффект будет иметь ту же величину, но противоположный знак. Для обратной реакции энергия активации составит величину. 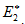
Зависимость константы скорости химической реакции от температуры описывается уравнением Аррениуса: 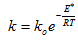 (3.10)
(3.10)
(где k – константа скорости реакции; ko – константа, зависящая от природы реагирующих веществ; Е* - энергия активации; R – универсальная газовая постоянная; Т – температура , К.) Константа скорости, а следовательно и скорость химической реакции, экспоненциально растет с увеличением температуры.
Вопрос №3. Стандартный электродный потенциал металла. Ряды cтандартных электродных потенциалов металлов и их применение для решения химических задач
Электродный потенциал - напряжение гальванического элемента, составленного из интересующего нас электрода и электрода сравнения. На практике в качестве электрода сравнения для водных растворов в качестве такого электрода принимают стандартный водородный электрод . Электродный потенциал, определенный для стандартных состояний - стандартный электродный потенциал. Если стандартные электродные потенциалы металлов расположить в порядке возрастания численных значений, то получится ряд напряжений металлов. Электродом можеть быть любой металл, погруженный в раствор соли, содержащий ионы металла. Вначале указывают окисленную форму в-ва, а после черты восстановленную. Кроме металлов электродами могут быть другие вещества, проводящие электрический ток.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностью веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
уравнения Нернста:
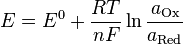
Чем больше стандартные восстановительные потенциалы, тем легче их можно восстановить, другими словами, тем более сильными окислителями они являются. И наоборот: большой отрицательный потенциал означает, что данная форма является сильным восстановителем. Например, F2 имеет 2,87 В, а Li+ имеет -3,05 В, фтор - окислитель, литий - восстановитель. Таким образом, Zn2+- стандартный восстановительный потенциал которого равен -0,76 В, может быть окислен любым другим электродом, стандартный потенциал которого больше -0,76 В. (напр., H+(0 В), Cu2+(0,16 В), F2(2,87 В)) и может быть восстановлен любым электродом, стандартный потенциал которого меньше -0,76 В (напр., H2(-2,23 В), Na+(-2,71 В), Li+(-3,05 В)).
|
из
5.00
|
Обсуждение в статье: Вопрос №2. Зависимость скорости химической реакции от температуры. Энергия активации |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

