 |
Главная |
Про гидролиз солей подробнее смотреть в вопросе №60
|
из
5.00
|
Вопрос №19. Планетарная модель атома водорода Резерфорда, постулаты Бора. Квантовомеханическая модель атома. Волновая функция.
Рассеяние a-частиц при прохождении через фольгу вызывается кулоновскими силами, т.е. электрическим взаимодействием частицы и заряда атома. Гравитационное взаимодействие в 10 33 раз меньше, поэтому фактически роли не играет. Какие же заряды в атоме вызывают рассеяние a-частиц? Электроны не могут этого сделать, так как их масса много меньше массы частицы: ma=7350me.При взаимодействии с электронами быстро движущаяся частица не изменяет направление своего движения. Причиной рассеяния a-частицы является их взаимодействие с положительно заряженными частицами атома, занимающими очень малую область атома. Резерфорд назвал эту область ядром. В ядре сосредоточена почти вся масса атома и весь положительный заряд. Обобщив результаты опытов, Резерфорд предложил следующую модель строения атома:
1. в центре атома - положительно заряженное ядро:
заряд ядра q = Z·e, где Z-порядковый номер элемента в таблице Менделеева, e =1.6·10-19 Кл - элементарный заряд;
размер ядра 10-13 см
масса ядра фактически равна массе атома.
2. электроны движутся вокруг ядра по круговым и эллиптическим орбитам, как планеты вокруг Солнца:
электроны удерживаются на орбите кулоновской силой притяжения к ядру, создающей центростремительное ускорение.
число электронов в атоме равно Z ( порядковый номер элемента)
электроны движутся с большой скоростью, образуя электронную оболочку атома.
Модель атома, предложенная Резерфордом, называется планетарной.
Квантовые постулаты Бора
Планетарная модель атома является внутренне противоречивой. Движущийся с ускорением заряд излучает электромагнитную волну. При этом энергия атома уменьшается: электрон должен упасть на ядро, а атом прекратить свое существование. На самом деле атомы химических элементов представляют собой устойчивые структуры, существующие десятки тысяч лет без изменения. Поэтому модель атома Резерфорда была дополнена рядом положений, автором которых является датский физик Бор.
В 1913 году Бор показал, что несовпадение с экспериментом выводов, основанных на модели Резерфорда, возникла потому, что поведение микрочастиц нельзя описывать теми же законами, что и макроскопических тел. Бор предположил, что величины характеризующие микромир, должны квантоваться, т.е. они могут принимать только определенные дискретные значения.
Законы микромира - квантовые законы! Эти законы в начале 20 столетия еще не были установлены наукой. Бор сформулировал их в виде трех постулатов. дополняющих ( и "спасающих") атом Резерфорда.
Первый постулат: Атомы имеют ряд стационарных состояний соответствующих определенным значениям энергий: Е1, Е2...En. Находясь в стационарном состоянии, атом энергии не излучает, несмотря на движение электронов.
Второй постулат: В стационарном состоянии атома электроны движутся по стационарным орбитам, для которых выполняется квантовое соотношение:
m·V·r = n·h/2·p (1)
где m·V·r =L - момент импульса, n=1,2,3..., h-постоянная Планка.
Третий постулат: Излучение или поглощение энергии атомом происходит при переходе его из одного стационарного состояния в другое. При этом излучается или поглощается порция энергии (квант), равная разности энергий стационарных состояний, между которыми происходит переход: e = h·u = Em-En
Постулаты Бора противоречат законам классической физики. Они выражают характерную особенность микромира - квантовый характер происходящих там явлений. Выводы, основанные на постулатах Бора, хорошо согласуются с экспериментом.
Волновая функция была определена как амплитуда фазовой волны. Понятие о фазовой волне формально и применение его оправдывается только тем, что связанные с ним выводы квантовой механики не противоречат опыту. Казалось бы, таким же формальным и не имеющим физического смысла должно быть и понятие об амплитуде фазовой волны ¥. Однако специальный анализ, сделанный М. Борном, показал, что квадрат волновой функции ¥ ** выражает вероятность местонахождения электрона в определенной точке пространства. Соответственно этому произведение 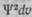 означает вероятность нахождения электрона в элементарном объеме
означает вероятность нахождения электрона в элементарном объеме 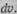
Таким образом, волновая функция в отличие от обычной волны дает статистическую картину поведения электрона в атоме или молекуле. Двигаясь около ядра, электрон может в любой момент находиться в любом месте; в той же области атомного пространства, где значения 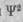 повышены, его пребывание чаще. Статистическая совокупность мест локализации электрона в атоме или, как говорят, электронное облако, обладающее определенным распределением электронной плотности, называется квантово-механической моделью атома. На рис. 1 схематически изображена модель атома водорода. В атоме водорода, представляющем собой одноэлектронную систему, электрон не свободен в движении из-за взаимодействия с ядром. Поэтому он может располагаться лишь на некоторых конечных расстояниях от ядра. Возможное местонахождение электрона изображено на рисунке в виде облака переменной интенсивности, которое характеризует вероятность (частоту) пребывания электрона в разных точках вокруг ядра. Пунктирная линия в облаке соответствует орбите, около которой электрон пребывает наиболее часто.
повышены, его пребывание чаще. Статистическая совокупность мест локализации электрона в атоме или, как говорят, электронное облако, обладающее определенным распределением электронной плотности, называется квантово-механической моделью атома. На рис. 1 схематически изображена модель атома водорода. В атоме водорода, представляющем собой одноэлектронную систему, электрон не свободен в движении из-за взаимодействия с ядром. Поэтому он может располагаться лишь на некоторых конечных расстояниях от ядра. Возможное местонахождение электрона изображено на рисунке в виде облака переменной интенсивности, которое характеризует вероятность (частоту) пребывания электрона в разных точках вокруг ядра. Пунктирная линия в облаке соответствует орбите, около которой электрон пребывает наиболее часто.
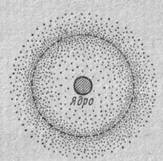
Рис- 1- Распределение вероятности локализации электрона в атоме водорода
Эта линия совпадает с основной орбитой в модели атома Бора. Таким образом, орбиты Бора характеризуют не единственно возможные положения электрона в атоме, а лишь его наиболее вероятные местонахождения. На это обстоятельство указывает и густота точек на рисунке, убывающая в обе стороны от средней пунктирной линии. Форму электронного облака для различных стационарных состояний электрона в атоме находят, решая уравнение Шредингера относительно ¥-функции. Решение представляет собой сложную математическую задачу. Приемы, используемые при решении, и особенности квантово-механического исследования стационарных состояний атома можно понять на примере простейшей задачи об атоме водорода.
|
из
5.00
|
Обсуждение в статье: Про гидролиз солей подробнее смотреть в вопросе №60 |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

