 |
Главная |
Вопрос №40. Комплексные соединения. Геометрическое строение комплексных ионов. Электролитическая диссоциация и константы нестойкости комплексных ионов.
|
из
5.00
|
Комплексные соединения (лат. complexus — сочетание, обхват), или координационные соединения — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами.
Строение комплексных соединений рассматривают на основе координационной теории, предложенной в 1893 г. швейцарским химиком Альфредом Вернером,
В соответствии с этой теорией в комплексных соединениях различают комплексообразователь,внешнюю и внутреннюю сферы. Комплексообразователем обычно является катион или нейтральный атом. Внутреннюю сферу составляет определенное число ионов или нейтральных молекул, которые прочно связаны с комплексообразователем. Их называют лигандами. Число лигандов определяет координационное число (КЧ) комплексообразователя.
Пример комплексного соединения
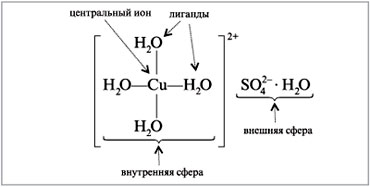
Рассмотренное в примере соединение [Cu(H2O)4)]SO4•H2O или CuSO4•5Н2О – это кристаллогидрат сульфата меди(II).
Комплексные соединения, имеющие внешнюю сферу, являются сильными электролитами и в водных растворах диссоциируют практически нацело на комплексный ион и ионы внешней сферы. Например:
[Cu(NH3)4]SO4 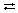 [Cu(NH3)4]2+ +
[Cu(NH3)4]2+ + 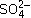 .
.
При обменных реакциях комплексные ионы переходят из одних соединений в другие, не изменяя своего состава:
[Cu(NH3)4]SO4 + BaCl2 = [Cu(NH3)4]Cl2 + BaSO4 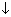 .
.
Внутренняя сфера может иметь положительный, отрицательный или нулевой заряд.
Если заряд лигандов компенсирует заряд комплексообразователя, то такие комплексные соединения называют нейтральными или комплексами-неэлектролитами: они состоят только из комплексообразователя и лигандов внутренней сферы.
Таким нейтральным комплексом является, например, [Pt(NH3)2Cl2].
Наиболее типичными комплексообразователями являются катионы d-элементов.
Лигандами могут быть:
а) полярные молекулы – NH3, Н2О, CO, NO;
б) простые ионы – F–, Cl–, Br–, I–, H–, H+;
в) сложные ионы – CN–, SCN–, NO2–, OH–.
Координационное число (К.Ч.) или координационная валентность – общее количество лигандов, входящих во внутреннюю сферу комплекса. Известны координационные числа 1, 2, 3, 4, 5, 6, 7, 8, 9, 12. Чаще других встречаются 4, 6 и 2. Эти числа соответствуют наиболее симметричной геометрической конфигурации комплекса – октаэдрической (6), тетраэдрической (4) и линейной (2)
Чем выше степень окисления комплексообразователя, тем больше координационное число: [Cu+(NH3)2]+, но [Cu2+(NH3)4]2+.
Незаряженные лиганды обычно присоединяются к комплексообразователю в большем числе, чем заряженные: [Сo(H2O)6]2+, но [СoCl4]2.-.
Например, с ионами Cl-, Br-, I- алюминий проявляет К.Ч. 4, а с меньшим ионом F- - 6: K[AlCl4],но K3[AlF6].
Электролитической диссоциацией называют процесс распада молекул на ионы под действием растворителя.
Вещества, молекулы которых подвергаются диссоциации, называются электролитами. К ним относятся кислоты, гидроксиды, соли.
Причиной диссоциации является взаимодействие между растворенным веществом и растворителем, в результате которого в растворе образуются гидратированные ионы:
КА + (n+m)H2O ↔ [K(H2O)n]+ + [A(H2O)m]¯
Электролитическая диссоциация комплексных ионов подчиняется закону действующих масс и количественно характеризуется константой диссоциации, которая носит название константы нестойкостиКн: 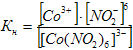
У типичных комплексных ионов Кн очень мала и является мерой его устойчивости.
Одним из главных отличий электролитов от не электролитов является способность их в водных растворах проводить электрический ток. При погружении в водный раствор электролита электродов, подключенных к источнику постоянного тока, положительно заряженные ионы (катионы) будут перемещаться к отрицательному электроду – катоду, а отрицательно заряженные ионы (анионы) к положительно заряженному электроду – аноду.
Ионы могут быть простыми, например: Na+, H+, Ca2+, Al3+, Cl¯, S2– и др., и сложными: OH¯, SO42–, PO43– и др.
Степень диссоциации α– выражается отношением числа молекул распавшихся на ионы (n) к общему числу растворенных молекул (n+N):
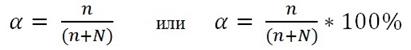
Степень электролитической диссоциации α зависит от природы растворенного вещества и растворителя, температуры, концентрации раствора (величина эта тем больше, чем более разбавлен раствор), добавления одноименных ионов (α понижается).
Степень диссоциации различных электролитов при постоянной температуре и концентрации колеблется в широких пределах.
Электролиты называют сильными, если α > 0,3 (> 30%). К ним относятся многие кислоты (H2SO4, HNO3, HCl, HBr, HI, HClO4,HMnO4, H2Cr2O7, H2Cr2O4 и др.), гидроксиды щелочных и щелочноземельных металлов, почти все растворимые соли.
Электролиты называют слабыми, если α < 0,03 (α < 3%). К ним относятся многие кислоты (HNO2, HF, H2CO3, H2SiO3, H3BO3 и др.), вода, водный раствор аммиака NH3* H2O, гидроксиды металлов и др.
Иногда в отдельную группу выделяют электролиты средней силы: H3PO4, H2SO3, H2C2O4. Их значения степени диссоциации (α) находятся в интервале от 0,03 до 0,3.
Для более точной оценки силы слабых электролитов служит константа электролитической диссоциации (Кд). Константа диссоциации Кдхарактеризует способность данного электролита в среде данного растворителя распадаться на ионы. Чем выше ее значение, тем больше концентрация ионов в сравнении с концентрацией нераспавшихся на ионы молекул электролита.
В общем виде для процесса электролитической диссоциации, выражаемого уравнением:
KmAn ↔ mKn+ + nAm-
константа диссоциации равна:
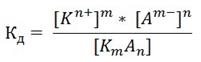
Например, для HF выражение константы диссоциации смеет следующий вид:
HF ↔ H+ + F¯
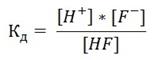
Значение константы диссоциации зависит от природы электролита, природы растворителя, температуры и не зависит от концентрации раствора. Данное свойство константы диссоциации позволяет определять силу слабых электролитов, пользуясь табличными значениями Кд. Чем больше константа диссоциации кислоты (основания), тем сильнее кислота (основание).
Например, Кд HCN = 7,2 ∙ 10-10; Кд HF = 7,2 ∙ 10-4, следовательно, плавиковая кислота (HF) более сильная, чем синильная (HCN).
Если вместо равновесия в реакциях образования комплексов рассматривать обратный процесс – реакции диссоциации комплексов (или реакции обмена лигандов на молекулы растворителя), то соответствующие константы будут носить название ступенчатых констант нестойкости комплексов.
Ступенчатые и общие константы образования и нестойкости комплексов соотносятся друг с другом как обратные величины:
bn(обр) = 1 / b n(нест); Kn(обр) = 1 / Kn(нест),
поэтому для сравнения прочности комплексов могут использоваться справочные данные как по значениям констант образования, так и констант нестойкости.
Ступенчатая диссоциация
Многоосновные кислоты и много кислотные основания в водных растворах диссоциируют ступенчато, т.е. вначале от молекулы отщепляется один из ионов, затем другой и т.д. Каждая такая ступень характеризуется своей константой – ступенчатой константой диссоциации (для комплексных соединений – константой нестойкости).
Например, серная кислота H2SO4 – сильная двухосновная кислота, диссоциирует в две ступени.
I ступень: H2SO4 ↔ H+ + HSO4¯
II ступень: HSO4¯ ↔ H+ + SO42–
Степень диссоциации (α) серной кислоты по каждой ступени близка к 1, поэтому для серной кислоты можно записать суммарное уравнение диссоциации:
H2SO4 ↔ 2H+ + SO42–
Для слабых многоосновных кислот суммарное уравнение диссоциации писать некорректно, т.к. наибольшую концентрацию ионов водорода обеспечивает диссоциация по I ступени.
I ступень: H2S ↔ H+ + HS¯ Кд I = 8,9 ∙ 10-8
II ступень: HS¯ ↔ H+ + S2– Кд II = 1,3 ∙ 10-15
Кд I > Кд II
Значения двух констант диссоциации показывают, что процесс диссоциации по второй ступени практически не протекает.
Все вышесказанное относится и к растворам многокислотных сильных и слабых гидроксидов (оснований).
Например, гидроксид бария Ba(OH)2 – сильный гидроксид:
I ступень: Ba(OH)2 ↔ BaOH+ + OH¯
II ступень: BaOH+ ↔ Ba2+ + OH¯
Суммарное уравнение: Ba(OH)2 ↔ Ba2+ + 2OH¯
Гидроксид магния Mg(OH)2 – слабый гидроксид:
I ступень: Mg(OH)2 ↔ MgOH+ + OH¯
II ступень: MgOH+ ↔ Mg2+ + OH¯
|
из
5.00
|
Обсуждение в статье: Вопрос №40. Комплексные соединения. Геометрическое строение комплексных ионов. Электролитическая диссоциация и константы нестойкости комплексных ионов. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

