 |
Главная |
Вопрос №37. Характеристики химической связи - энергия, длина, кратность, полярность. Причина образования химической связи
|
из
5.00
|
Энергия связи – это энергия, которая выделяется при образовании молекулы из одиночных атомов. Энергия связи отличается от ΔHобр. Теплота образования – это энергия, которая выделяется или поглощается при образовании молекул из простых веществ.( Энергии связей в молекулах, состоящих из одинаковых атомов, уменьшаются по группам сверху вниз)
Для двухатомных молекул энергия связей равна энергии диссоциации, взятой с обратным знаком: например в молекуле F2 энергия связи между атомами F-F равна - 150,6 кДж/моль. Для многоатомных молекул с одним типом связи, например, для молекул АВn, средняя энергия связи равна 1/n части полной энергии образования соединения из атомов. Так, энергия образования СН4 = -1661,1 кДж/моль.
Если в молекуле соединяются более двух различных атомов, то средняя энергия связи не совпадает с величиной энергии диссоциации молекулы. Если в молекуле представлены различные типы связи, то каждому из них можно приближенно приписать определенное значение Е. Это позволяет оценить энергию образования молекулы из атомов. Например, энергию образования молекулы пентана из атомов углерода и водорода можно вычислить по уравнению:
Е = 4EC-C + 12EC-H.
Длина связи – это расстояние между ядрами взаимодействующих атомов. Ориентировочно оценить длину связи можно, исходя из атомных или ионных радиусов, или из результатов определения размеров молекул с помощью числа Авогадро. Так, объем, приходящийся на одну молекулу воды: 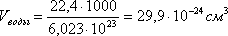 , отсюда
, отсюда 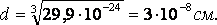
Чем выше порядок связи между атомами, тем она короче.
Кратность: Кратность связи определяется количеством электронных пар, участвующих в связи между атомами. Химическая связь обусловлена перекрыванием электронных облаков. Если это перекрывание происходит вдоль линии, соединяющей ядра атомов, то такая связь называется σ-связью. Она может быть образована за счет s – s электронов, р – р электронов, s – р электронов. Химическая связь, осуществляемая одной электронной парой, называется одинарной.
Если связь образуется более чем одной парой электронов, то она называется кратной.
Кратная связь образуется в тех случаях, когда имеется слишком мало электронов и связывающихся атомов, чтобы каждая пригодная для образования связи валентная орбиталь центрального атома могла перекрыться с какой-либо орбиталью окружающего атома.
Поскольку р-орбитали строго ориентированы в пространстве, то они могут перекрываться только в том случае, если перпендикулярные межъядерной оси р-орбитали каждого атома будут параллельны друг другу. Это означает, что в молекулах с кратной связью отсутствует вращение вокруг связи.
Полярность: Если двухатомная молекула состоит из атомов одного элемента, как, например, молекулы Н2, N2, Cl2 и т. п., то каждое электронное облако, образованное общей парой электронов и осуществляющее ковалентную связь, распределяется в пространстве симметрично относительно ядер обоих атомов. В подобном случае ковалентная связь называется неполярной или гомеополярной. Если же двухатомная молекула состоит из атомов различных элементов, то общее электронное облако смещено в сторону одного из атомов, так что возникает асимметрия в распределении заряда. В таких случаях ковалентная связь называется полярной или гетерополярной.
Для оценки способности атома данного элемента оттягивать к себе общую электронную пару пользуются величиной относительной электроотрицательности. Чем больше электроотрицательность атома, тем сильнее притягивает он общую электронную пару. Иначе говоря, при образовании ковалентной связи между двумя атомами разных элементов общее электронное облако смещается к более электроотрицательному атому, и в тем большей степени, чем больше различаются электроотрицательности взаимодействующих атомов.
Смещение общего электронного облака при образовании полярной ковалентной связи приводит к тому, что средняя плотность отрицательного электрического заряда оказывается выше вблизи более электроотрицательного атома и ниже - вблизи менее электроотрицательного. В результате первый атом приобретает избыточный отрицательный, а второй - избыточный положительный заряд; эти заряды принято называть эффективными зарядами атомов в молекуле.
Причина образования химической связи - является стремление атомов металлов и неметаллов путём взаимодействия с другими атомами достичь более устойчивой электронной структуры, подобной структуре инертных газов. Различают три основных вида связи: ковалентную полярную, ковалентную неполярную и ионную.
Ковалентная связь называется неполярной, если общая электронная пара в равной степени принадлежит обоим атомам. Ковалентная неполярная связь возникает между атомами, электроотрицательности которых одинаковы (между атомами одного и того же неметалла),т.е. в простых веществах. Например, в молекулах кислорода, азота, хлора, брома связь ковалентная неполярная.
Ковалентная связь называется полярной, если общая электронная пара смещена к одному из элементов. Ковалентная полярная связь возникает между атомами, электроотрицательности которых отличаются, но не сильно, т.е. в сложных веществах между атомами неметаллов. Например, в молекулах воды, хлороводорода, аммиака, серной кислоты связь ковалентная полярная.
Ионная связь – это связь между ионами, осуществляется за счёт притяжения разноимённо заряженных ионов. Ионная связь возникает между атомами типичных металлов (главная подгруппа первой и второй группы) и атомами типичных неметаллов (главная подгруппа седьмой группы и кислород).
|
из
5.00
|
Обсуждение в статье: Вопрос №37. Характеристики химической связи - энергия, длина, кратность, полярность. Причина образования химической связи |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

