 |
Главная |
Вопрос №26. Равновесия в насыщенных растворах малорастворимых солей. Расчёт растворимости малорастворимой соли. Способы уменьшения или увеличения растворимости.
|
из
5.00
|
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
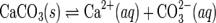
Константа этого равновесия рассчитывается по уравнению:
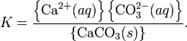
В приближении идеального раствора с учётом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:
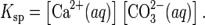
Константа равновесия такого процесса называется произведением растворимости
Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении.
Произведение концентраций ионов в насыщенном растворе малорастворимого электролита представляет собой величину постоянную при данной температуре.
Для расчета растворимости малорастворимого соединения используют выражение для концентрационного произведения растворимости Ks.
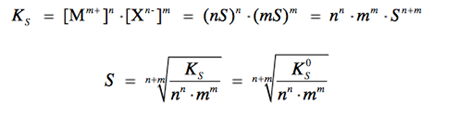

Способы уменьшения или увеличения растворимости.
1. Изменение рН растворов.
СаС03⇄Са2++СО32-
осадок раствор
Если к раствору прилить сильную кислоту, то ионы водорода, соединяясь с ионами соли, приводят к образованию новых соединений:
Са2++ СО32-+2Н+ = Са2++Н20+С02
2. Присутствие аммонийных солей сильных кислот в растворах гидроксидов, оксикарбонатов.
Mg(OH)2 ⇄ Mg2++20H-
осадок раствор
Прибавление к раствору Mg(OH)2 аммонийных солей вызывает растворение осадка Mg(OH)2. Хлорид аммония хорошо диссоциирует:
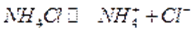
3. Присутствие комплексообразователей в растворах малорастворимых солей.
Например, при осаждении CaSO4 избытком сульфата аммония наблюдается повышение растворимости осадка вследствие образования более растворимой комплексной соли:
CaS04+(NH4)2S04=(NH4)2[Ca(S04)2]
При добавлении гидроксида аммония к гидроксидам Сu2+, Ni2+, Co2+ и другим соединениям осадки растворяются:
Cu(OH)2+4NH4OH = [Cu(NH3)4](OH)2+4H20
3. Присутствие посторонних ионов, не входящих в состав малорастворимого соединения (солевой эффект).
Растворимость некоторых малорастворимых солей увеличивается в присутствии других солей, не имеющих с ними общих ионов. Известно, что растворимость BaS04, SrS04 и CaS04 увеличивается с прибавлением растворов KN03, NaCl и др., причем растворимость солей увеличивается с повышением концентрации прибавленной соли. Это явление называют солевым эффектом.
При добавлении к малорастворимому электролиту посторонней соли межионные силы взаимодействия возрастают и коэффициенты активности ионов, составляющих молекулу малорастворимого электролита, уменьшаются до значений меньше единицы. Это вызывает увеличение растворимости электролита, так как раствор становится ненасыщенным вследствие введения посторонних ионов.
5. Присутствие окислителей или восстановителей в растворах малорастворимых соединений.
6. Изменение температуры.
Растворимость большинства осадков, которые встречаются в анализе, увеличивается с повышением температуры. Это справедливо для тех веществ, растворимость которых сопровождается поглощением теплоты. Растворимость некоторых веществ весьма значительно увеличивается с ростом температуры. Реже встречаются случаи, когда растворимость падает с увеличением температуры. Растворимость некоторых веществ сначала возрастает с повышением температуры, а затем начинает падать, например сульфата кальция.
7. Влияние растворителя.
Растворимость полярных соединений в полярных растворителях больше, чем в неполярных. Поэтому при добавлении к воде органических растворителей растворимость неорганических солей, как правило, уменьшается.
* Влияние давления.
С повышением давления растворимость газов в жидкостях увеличивается, а с понижением уменьшается.
|
из
5.00
|

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

