 |
Главная |
Вопрос №41. Динамический характер химического равновесия. Влияние внешних факторов (температура, давление) на состояние равновесия.
|
из
5.00
|
Химическое равновесие имеет динамический характер. Это значит, что и прямая и обратная реакции при равновесии не прекращаются.
Для одностадийной обратимой реакции

при равновесии выражения для скоростей прямой V1 и обратной реакций V2 имеют вид:

где [A], [B], [C] и [D] - равновесные молярные концентрации веществ A, B, C и D;
a,b,c и d - соответствующие стехиометрические коэффициенты (при условии, что реакция идет в одну стадию);
k1 и k2 -коэффициенты пропорциональности, называемые константами скоростей.
Из условия равновесия V1=V2 следует:

Отсюда получаем выражение для константы равновесия Kp:

Чем выше величина Kp, тем больше в равновесной смеси продуктов прямой реакции.
Влияние внешних факторов (температура, давление) на состояние равновесия.
Равновесие можно сместить внешним воздействием, руководствуясь принципом Ле Шателье: если на равновесную систему оказывать внешнее воздействие, то равновесие смещается в сторону, противодействующую этому воздействию.
1. Влияние температуры. Для реакций, идущих с уменьшением энтальпии (экзотермических), повышение температуры будет препятствовать протеканию прямого процесса, то есть смещать реакцию в сторону исходных веществ. Эндотермические реакции при этом будут смещаться в сторону конечных продуктов. Например, при обычных условиях реакция N2 + O2 не идет (ΔH > 0), но повышение температуры может сделать эти реакцию осуществимой. Реакция CO + 1/2O2 = CO2, ΔH < 0 с повышением температуры будут смещаться в сторону исходных веществ.
2. Влияние давления. Если реагируют газообразные вещества, то при неизменном числе молей начальных и конечных реагентов повышение общего давления не приведет к смещению равновесия. Если число молей при реакции меняется, то изменение общего давления приведет к смещению равновесия. В частности, реакция 2CO + O2 = 2CO2, протекающая с уменьшением Δn, при повышении общего давления сместится в сторону образования СO2.
3. Влияние концентраций. В тех реакциях, в которых лучше оперировать концентрациями (реакции в растворах), увеличение концентраций исходных веществ приводит к смещению равновесия в сторону конечных продуктов и наоборот. Так, в реакции этерификации (образование сложного эфира).
Вопрос №42. Электролитическая диссоциация воды. Ионное произведение воды Kw, его зависимость от температуры. Водородный показатель как универсальная характеристика водных растворов.
Электролитическая диссоциация воды:
Вода представляет собой слабый амфотерный электролит:
Н2О = Н+ + ОН-
или, более точно:
2Н2О = Н3О+ + ОН-
Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды.
Константа диссоциации воды при 25С равна:

ионным произведением воды KW при 25оС:
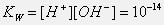
Таблица: Изменение ионного произведения воды в зависимости от температуры
Температура Кw
10 0,29
20 0,68
25 1,00
30 1,47
40 2,92
Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды.
С повышением температуры диссоциация воды увеличивается, значит ионное произведение воды тоже увеличивается, а показатель степени по абсолютной величине уменьшается. Так, в нейтральной среде при 100С в чистой воде рН составляет 6,12, а при 0С рН жидкой воды – 7,97
Водородный показатель
Водоро́дныйпоказа́тель, pH — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный десятичный логарифм активности водородных ионов, выраженной в молях на литр:

Вычисление:
 ; рОН-=-lg[ OH-]; рН + рОН =14
; рОН-=-lg[ OH-]; рН + рОН =14
Концентрация любого иона в моль/л в растворе электролита можно вычислить по уравнению

где См иона – молярная концентрация иона в моль/л;
См – молярная концентрация электролита в моль/л;
 -степень диссоциации электролита;
-степень диссоциации электролита;
n - количество ионов данного вида, которое получается при распаде одной молекулы электролита.
Если электролит слабый, то значение степени диссоциации может быть определено на основании закона разбавления Оствальда:
 ; тогда
; тогда  = √ СмКдис
= √ СмКдис
Пример. Вычислить рН 0,001H раствора гидроксида натрия.
Решение: гидроксид натрия является сильным электролитом, диссоциация в водном растворе происходит по схеме:

Степень диссоциации в разбавленном растворе можно принять равной 1. Концентрация ионов ОН  (моль/л) в растворе равна:
(моль/л) в растворе равна:

|
из
5.00
|
Обсуждение в статье: Вопрос №41. Динамический характер химического равновесия. Влияние внешних факторов (температура, давление) на состояние равновесия. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

