 |
Главная |
Вопрос №18. Электролитическая диссоциация в растворах. Кислоты, основания, амфотерные гидроксиды, соли. Сильные и слабые электролиты
|
из
5.00
|
Электроли́ты — вещества, расплавы или растворы, которые проводят электрический ток вследствие диссоциации на ионы, однако сами вещества не проводят электрический ток.
Известно, что существуют две основные причины прохождения электрического тока через проводники: либо за счет движения электронов в электрическом поле, либо за счет движения ионов. Электронная проводимость присуща, прежде всего, металлам.
Ионная проводимость присуща многим химическим соединениям, обладающим ионным строением, например солям в твердом или расплавленном состояниях, а также многим водным и неводным растворам. В связи с этим все вещества принято условно делить по их поведению в растворах на две категории:
а) вещества, растворы которых обладают ионной проводимостью (электролиты);
б) вещества, растворы которых не обладают ионной проводимостью (неэлектролиты).
К электролитам относится большинство неорганических кислот, оснований и солей. К неэлектролитам относятся многие органические соединения, например спирты, углеводы.
Электролитическая диссоциация.
Под электролитической диссоциацией понимается распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов — катионов и анионов.
Степень диссоциации.
Степенью диссоциации а называется отношение числа молекул, распавшихся на ионы (n'), к общему числу растворенных молекул (п):
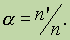
Из этого выражения очевидно, что а может изменяться от 0 (диссоциации нет) до 1 (полная диссоциация). Степень диссоциации часто выражают в процентах. Степень диссоциации электролита может быть определена только экспериментальным путем, например по измерению температуры замерзания раствора, по электропроводности раствора и т. д.
Сильные и слабые электролиты. В зависимости от степени диссоциации различают электролиты сильные и слабые.Электролиты со степенью диссоциации больше 30% обычно называют сильными, со степенью диссоциации от 3 до 30% — средними, менее 3% — слабыми электролитами.
К сильным электролитам относятся почти все соли, некоторые кислоты (НСl, HBr, HI, НNО3, НСlO4, Н2SO4(разб.)) и некоторые основания (LiОН, NaOH, КОН, Са(ОН)2, Sr(OH)2, Ва(ОН)2). К слабым электролитам относится большинство кислот (особенно органических) и оснований.
Степень диссоциации как сильных, так и слабых электролитов зависит от концентрации раствора (степень диссоциации тем выше, чем более разбавлен раствор).
Кислоты. Кислотой называется соединение, образующее при диссоциации в водном растворе из положительных ионов только ионы водорода Н+. В соответствии с этими определениями к кислотам относятся, например, НСl, H2SO4, HNO3, H2S.
Примеры уравнений диссоциации кислот можно записать с учетом гидратации ионов:
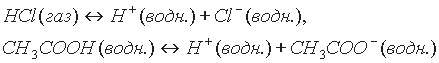
Числом ионов водорода, образуемых каждой молекулой кислоты при диссоциации, определяется заряд кислотного остатка (аниона). Соляная и азотная кислоты образуют только однозарядные кислотные остатки (Сl- ,NО3-); молекула серной кислоты Н2SO4 может образовать два кислотных остатка: однозарядный (НSO4-) и двухзарядный (SO42-); молекула фосфорной кислоты может дать три кислотных остатка: однозарядный, двухзарядный и трехзарядный (Н2РО4-, НРО42- и РО43-).
Различают кислородные и бескислородные кислоты. Как показывает само название, первые содержат кислород (например Н2SO4, НNO3, Н3РО4), вторые его не содержат (например, НСl, НВr, НI, H2S).
Названия кислородных кислот производятся от названия неметалла с прибавлением окончаний -ная, -вая, если степень окисления его соответствует номеру группы. По мере понижения степени окисления суффиксы меняются в следующем порядке: -оватая, -истая, -оватистая.
Если элемент в одной и той же степени окисления образует несколько кислородсодержащих кислот, то к названию кислоты с меньшим содержанием кислородных атомов добавляется префикс “мета”, при наибольшем числе — префикс “орто”.
Названия бескислородных кислот производятся от названия неметалла с окончанием -о и прибавлением слова водородная.
Основания. Основанием называется соединение, образующее при диссоциации в водном растворе из отрицательных ионов только гидроксид-ионы ОН- . В соответствии с этими определениями к основаниям относятся, например, NaOH, Са(ОН)2, NH4OH.
Диссоциацию оснований с учетом гидратации ионов следует писать так:
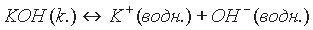
Амфотерные гидроксиды. Амфотерными называются такие гидроксиды, которые при диссоциации образуют одновременно и катионы водорода Н+, и гидроксид-ионы ОН-. Такими являются Аl(ОН)3, Zn(ОН)2, Сr(ОН)3, Ве(ОН)2, Gе(ОН)2, Sn(ОН)4, Рb(ОН)2 и др.
Амфотерные гидроксиды взаимодействуют как с растворами кислот, так и с растворами щелочей:
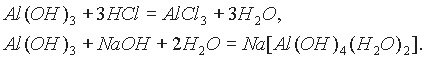
В настоящее время растворение амфотерных гидроксидов в щелочных растворах обычно рассматривается как процесс образования гидроксосолей (гидроксокомплексов).
Такой подход не меняет сделанных выводов: у амфотерного гидроксида, например у Аl(ОН)3 и ему подобных, в кислой среде равновесие смещается в сторону образования солей алюминия, в щелочной — в сторону образования гидроксокомплексов. Очевидно, в водном растворе существует равновесие, которое более точно описывается уравнением:
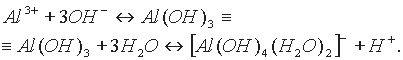
Cоли. Солями называются соединения, образующие при диссоциации в водном растворе положительно заряженные ионы металлов и отрицательно заряженные ионы кислотных остатков, а иногда, кроме них, ионы водорода и гидроксид-ионы:
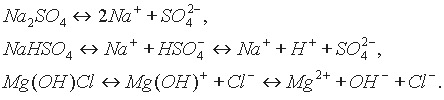
В соответствии с данным определением соли делятся на средние (Na2SO4), кислые (NaHSO4) и основные (Mg(OH)Cl).
После Аррениуса было показано, что определение кислот, солей и оснований в терминах теории электролитической диссоциации не охватывает всего многообразия кислотно-основных свойств веществ.
Так, например, в рамки приведенных определений не укладывается NH4Cl, NH3 и др.
Уравнения диссоциации солей, с учетом гидратации ионов, следует записывать так:
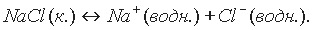
Любую соль можно представить как продукт взаимодействия основания и кислоты, т.е. реакции нейтрализации:
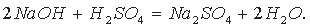
Уравнение диссоциации средней соли Na2SO4 можно записать так:
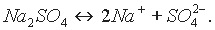
Если основания взято меньше, чем требуется для полной нейтрализации серной кислоты, то при упаривании будут выпадать кристаллы кислой соли:
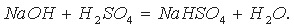
Диссоциацию кислой соли можно выразить уравнением:
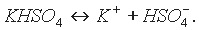
Анион кислой соли подвергается вторичной диссоциации как слабый электролит:
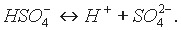
Кислые соли образуются многоосновными кислотами. Одноосновные кислоты кислых солей не образуют.
Основные соли можно представить как продукт неполного замещения гидроксогрупп основания на кислотные остатки:
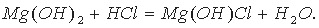
Диссоциацию основной соли можно выразить уравнением
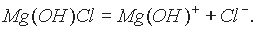
Катион основной соли в незначительной степени подвергается дальнейшей диссоциации:
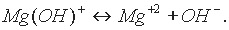
Двойные соли состоят из ионов двух разных металлов и кислотного остатка. Например, КАl(SO4)2, (NН4)2Fe(SO4)2. Диссоциацию таких солей можно выразить уравнениями:
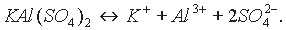
Двойные соли диссоциируют на ионы металлов и кислотного остатка.
В состав комплексных солей входят сложные (комплексные) ионы (в формулах они заключаются в квадратные скобки), которые и отщепляются при диссоциации:
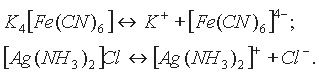
В свою очередь сложные (комплексные) ионы в очень малой степени подвергаются дальнейшей диссоциации:
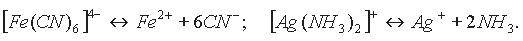
Таким образом, комплексные соли при диссоциации сначала отщепляют комплексные ионы, которые затем подвергаются вторичной диссоциации как слабые электролиты.
|
из
5.00
|
Обсуждение в статье: Вопрос №18. Электролитическая диссоциация в растворах. Кислоты, основания, амфотерные гидроксиды, соли. Сильные и слабые электролиты |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

