 |
Главная |
Кислородосодержащих кислот хлора
|
из
5.00
|
Бесцветная подвижная, дымящаяся на воздухе жидкость, самая устойчивая (из кислородосодержащих кислот хлора).
Получение:
KClO4(кр) + H2SO4(конц) → K2SO4 (или KHSO4) + HClO4
Отгонкой этого раствора при пониженном давлении получают 100 % HClO4. Она нестойка и может взрываться при хранении, при нагревании выше 900С разлагается со взрывом. Её разбавленные растворы не проявляют окислительных свойств. Хлорная кислота более слабый окислитель, чем хлорноватая. Её соли – перхлораты хорошо растворимы в воде, кроме КClO4. При нагревании выше 300-6000С они разлагаются с выделением кислорода: КClO4  KCl + O2.
KCl + O2.
HClO4 и её соли получают также электрохимическим окислением хлоратов (ClO3-) или хлоридов(Cl-) (анод – платина).
HClO HClO2 HClO3 HClO4
 увеличивается сила кислот
увеличивается сила кислот
уменьшаются окислительные свойства
В ряду увеличивается число атомов кислорода, это приводит к тому, что атомы кислорода оттягивают на себя электронную плотность, хлор становится положительнее и оттягивает эл. плотность от кислорода, а тот от водорода (О-Н), водород становится подвижным и легче отрывается ═► кислота становится сильнее.
Уменьшение окислительных свойств объясняется тем, что у HClO4 все атомы кислорода равномерно распределяются относительно хлора, электрону трудно подойти, поэтому она слабый окислитель.
HBrO (бромноватистая, гипобромиты) - известна только в водных растворах.
HIO (иодноватистая, гипоиодиты) - ещё менее устойчива. Соли этих кислот малоустойчивы и легко диспропорционируют:
KBrO 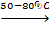 KBr +KBгO3
KBr +KBгO3
KIO  KI +KIO3
KI +KIO3
HBrO2 и HIO2 не известны.
HBrO3 – бромноватая кислота мало устойчива, она образуется при взаимодействии броматов с серной кислотой:
Ba(BrO3)2 + H2SO4 → BaSO4 + HBrO3
Или по реакции: Br2 + H2O + Cl2 → HCl + HBrO3
HIO3 –сильная кислота, более устойчивая, чем HBrO3, её получают окислением иода концентрированной азотной кислотой:
I2 + HNO3 (конц) → HIO3 + NO + H2O
при обычных условиях белое кристаллическое вещество, хорошо растворимое в воде, кристаллы плавятся при 1000С с потерей воды. При 2000С переходят в иодноватый ангидрид (оксид):
HIO3  I2O5 + H2O
I2O5 + H2O
HIO3 сильный окислитель: HIO3 + HI → I2 + H2O (HI – только восстановитель, если элемент в данном случае иод является и окислителем, и восстановителем, то образуется одно соединение с промежуточной степенью окисления).
Подобно хлоратам, броматы и иодаты в нейтральных и щелочных средах не проявляют окислительных свойств. Они также взрывоопасны (при нагревании или ударе). Их получают электролитическим окислением галогенидов в щелочных растворах или растворением галогенов в растворах щелочей при небольшом нагревании (в теплых растворах).
 + 6
+ 6 
 + 3 Н2О на аноде
+ 3 Н2О на аноде
Г2 + NaOH → NaГ + NaГО3 + Н2О Г – Br, I
HBrO4 – бромная кислота, в свободном состоянии не получена, существует только в растворе. Её соли – перброматы получены сравнительно недавно и недостаточно изучены.
NaBrO3 + NaOH + F2 → NaBrO4 + NaF + H2O (только с очень сильным окислителем)
HIO4 –получена в свободном виде, в зависимости от условий существует в нескольких формах:
(HIO4)x∙(H2O)y, где x и y изменяются от 0 до 2.
x=1, y=0 HIO4 метаиодная
x=1, y=1 H3IO5 мезоиодная
x=1, y=2 H5IO6 ортоиодная – получена в свободном виде (её называют иодной)
x=2, y=1 H4I2O9 дииодная
H5IO6 – бесцветное кристаллическое вещество, растворимое в воде, сильная кислота, её получают из солей:
Ba5(IO6)2 + H2SO4 → BaSO4 + H5IO6
Cоли – ортопериодаты получены по реакциям:
NaOH + H5IO6 → Na5IO6 + H2O (нейтрализации)
Ba(IO3)2 t→ Ba5(IO6)2 + I2 + O2 (диспропорционирования)
KIO3 + Cl2 + KOH → K5IO6 + KCl + H2O (окислением иодатов хлором в щелочной среде)
При окислении иодатов щелочных металлов гипохлоритом в щелочной среде образуются метаиодаты (пр. КIO4).
|
из
5.00
|
Обсуждение в статье: Кислородосодержащих кислот хлора |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

