 |
Главная |
Синтез и свойства 1,2,3-дитиазолов. Литературный обзор
|
из
5.00
|
Содержание
Введение
1. Синтез и свойства 1,2,3-дитиазолов. Литературный обзор
1.1 Методы синтеза
1.1.1 Соли 1,2,3-дитиазолия
1.1.2 5-Арилимино-4-хлор-5Н-1,2,3-дитиазолы
1.1.3 1,2,3-Дитиазол-3-оны
1.1.4 1,2,3-Дитиазол-3-тионы
1.1.5 5-Алкилиден-5Н-1,2,3-дитиазолы
1.1.6 Конденсированные 1,2,3-дитиазолы
1.1.7 Радикалы 1,2,3-дитиазолия
1.2 Химические свойства
1.2.1 Реакции 5-арилимино-4-хлор-5Н-1,2,3-дитиазолов
1.2.2 Реакции 1,2,3-дитиазол-5-онов
1.2.3 Реакции 1,2,3-дитиазол-5-тионов
1.2.4 Реакции 5-алкилиден-5Н-1,2,3-дитиазолов
1.2.5 Реакции конденсированных 1,2,3-дитиазолов
1.3 Cпектральные исследования
1.3.1 Рентгеноструктурный анализ
1.3.2 Спектроскопия ЯМР
1.3.3 Масс-спектрометрия
1.3.4. УФ- и ИК-спектроскопия
1.3.5 Электрохимические методы
1.3.6 ЭПР-спектроскопия
1.3.7 Квантово-химические расчеты молекул 1,2,3-дитиазолов
1.4 Биологическая активность и практическое применение 1,2,3-дитиазолов
Заключение
2. Обсуждение результатов
2.1 Разработка методов синтеза 4-замещенных 5Н-1,2,3-дитиазолов
2.1.1 Разработка метода синтеза 4-фенил-5Н-1,2,3-дитиазол-5-она 4а
2.1.2 Синтез 4-замещенных 5Н-1,2,3-дитиазол-5-онов 4
2.1.3 Синтез 4-замещенных 5H-1,2,3-дитиазол-5-тионов 6.
2.1.4 Синтез 4-замещенных 5H-1,2,3-дитиазол-5-иминов 7
2.1.5 Синтез 4-замещенных 5H-1,2,3-дитиазол-5-илиденов 9 и 10
2.1.6 Действие восстанавливающими реагентами на 4-замещенные соли 1,2,3-дитиазолия
2.1.7 Предполагаемый механизм образования 4-замещенных солей 1,2,3-дитиазолия из этаноноксимов
2.2 Химические свойства 4-замещенных 5H-1,2,3-дитиазолов
2.2.1 Реакции 4-замещенных 5H-1,2,3-дитиазолов с первичными аминами
2.2.2 Реакции 4-замещенных-5H-1,2,3-дитиазолов со вторичными аминами
2.2.3 Предполагаемый механизм взаимодействия 4-замещенных 5Н-1,2,3-дитиазолов 4 и 6 с первичными и вторичными аминами
2.2.4 Реакции 4-замещенных 5H-1,2,3-дитиазолов с этилатом натрия.
2.3 Биологическая активность синтезированных соединений
2.3.1 Антипролиферативная активность 4-замещенных 5Н-1,2,3-дитиазол-5-она 4a, -5-тионов 6 и -5-фенилиминов 7
2.3.2 Антибактериальная и фунгицидная активности 4-замещенных 5H-1,2,3-дитиазол-5-она 4a, -5-тионов 6 и -5-фенилиминов 7
2.4 Выводы
3 Экспериментальная часть
3.1 Синтез 4-замещенных 5Н-1,2,3-дитиазолов
3.1.1 Синтез 4-замещенных 5Н-1,2,3-дитиазол-5-онов 4.
3.1.2 Синтез 4-замещенных 5Н-1,2,3-дитиазол-5-тионов 6
3.1.3 Синтез 4-замещенных 5Н-1,2,3-дитиазол-5-фенилиминов 7
3.1.4 Синтез 4-замещенных 5Н-1,2,3-дитиазол-5-илиденов 9 и 10
3.1.5 Синтез 4,4'-дизамещенных 5,5'-би-1,2,3-дитиазолов 11
3.2 Реакции 4-замещенных 5Н-1,2,3-дитиазолов с первичными и вторичными аминами
3.2.1 Получение 2,4-дизамещенных 1,2,5-тиадиазолов 16 и 19
3.2.2 Получение N-бензил-2-оксопропанамида 20b
3.2.3 Получение 2-иминотиоацетамидов 22, 2-оксоацетамидов 23, 2-иминоацетамида 24
3.3 Реакции 4-замещенных 5Н-1,2,3-дитиазолов с этилатом натрия.
3.3.1 Получение 5,5-диэтокси-4-замещенных 5H-1,2,3-дитиазолов 27
3.3.2 Получение этиловых эфиров замещенной оксоуксусной кислоты 30
3.3.3 Получение N-фенил-2-оксотиоацетамидов 34
3.3.4 Получение N-фенилцианотиоформамида 35
Литература
Введение
Актуальность проблемы.
Моноциклические неконденсированные 1,2,3-дитиазолы являются особо интересным классом серосодержащих гетероциклов благодаря широте спектра применения и биологической активности. В зависимости от природы заместителя они могут проявлять бактерицидную, фунгицидную и антипролиферативную активность. Отдельные представители этого класса соединений способны образовывать стабильные катион-радикалы, проявляющие свойства электрических проводников и магнитных материалов.
Известны и широко изучены 1,2,3-дитиазолы, содержащие в четвертом положении атом хлора. На основе хлорида 4,5-дихлор-5H-1,2,3-дитиазолия – соли Аппеля, получен и подробно изучен широкий ряд функциональных производных - кетон, тион, иминов и илиденов, показанных ниже.
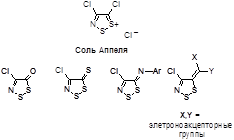
Следует отметить, что другие 4-замещенные 1,2,3-дитиазолы ранее практически изучены не были. Между тем, эти соединения могут иметь совершенно другие химические свойства из-за отсутствия в молекуле легко уходящего атома хлора, а также обладать перспективными свойствами в прикладном плане. Поэтому разработка эффективных способов получения 4-замещенных 1,2,3-дитиазолов, которые открыли бы широкие возможности для изучения свойств этих перспективных соединений, является актуальной задачей.
Цель работы.
Целью настоящей диссертационной работы является разработка удобных однореакторных методов синтеза 4-замещенных 1,2,3-дитиазолов на основе реакций этаноноксимов с монохлоридом серы, исследование реакционной способности 4-замещенных 1,2,3-дитиазолов и создание на их основе новых серосодержащих гетероциклических систем и нециклических функциональных производных, полезных в препаративном и прикладном планах.
Научная новизна и практическая ценность работы.
Систематически исследовано взаимодействие этаноноксимов с монохлоридом серы, разработаны новые, удобные, однореакторные методы синтеза ранее неизвестных 4-замещенных производных 5Н-1,2,3-дитиазолов: кетонов, тионов, иминов и илиденов.
Предложена оригинальная и простая методика синтеза бициклической системы – би-5,5'-1,2,3-дитиазолов.
Исследованы химические свойства 4-замещенных 5Н-1,2,3-дитиазолов. Показано, что реакции 4-замещенных 5Н-1,2,3-дитиазолов с нуклеофильными реагентами, в отличие от 4-хлорзамещенных производных, могут приводить к новым гетероциклическим продуктам.
Впервые найдены условия превращения 4-замещенных 5Н-1,2,3-дитиазол-5-онов и -5-тионов в 2,4-дизамещенные 1,2,5-тиадиазол-5-оны и -5-тионы под действием первичных алифатических аминов.
Показано, что взаимодействие 4-замещенных 5Н-1,2,3-дитиазол-5-онов и 5-тионов со вторичными аминами протекает с образованием 2-оксоацетамидов и 2-иминотиоацетамидов, соответственно.
Установлено, что реакция этилата натрия с 4-замещенными 5Н-1,2,3-дитиазол-5-тионами, -5-онами и -5-иминами, протекает разными путями, приводя к ранее неизвестным 4-замещенным 5,5-диэтокси-5H-1,2,3-дитиазолам, 2-замещенным эфирам -оксоуксусных кислот, и -оксотиоацетамидам, соответственно.
Синтез и свойства 1,2,3-дитиазолов. Литературный обзор
Среди пятичленных сера-азотистых гетероциклов 1,2,3-дитиазолы занимают важное место благодаря интересным физическим и биологическим свойствам, а также разнообразной химии их производных. Из соединений этого класса известны как положительно заряженные моноциклические и конденсированные 1,2,3-дитиазолы 1, так и нейтральные 1,2,3-дитиазол-5-оны и их производные 2, бициклические гетеропенталены 3. Особое место среди соединений этого класса занимают интенсивно исследуемые в последнее время стабильные конденсированные 1,2,3-дитиазолильные радикалы 4, которые предлагаются для использования в качестве проводящих и магнитных материалов.
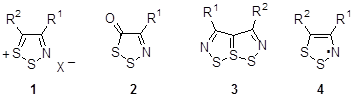
Моноциклические дитиазолы получают в большинстве случаев из ключевого соединения – хлорида 4,5-дихлор-1,2,3-дитиазолия 1a (R1 = R2 = X = Cl) – так называемой соли Аппеля.[1] Конденсированные с бензольным циклом 1,2,3-дитиазолы широко известны как соли Герца и были впервые получены более 80 лет назад. Тем не менее, они интенсивно исследуются и в настоящее время, хотя, зачастую, получаются отличными от классического методами.
Обзор по синтезу и реакциям 1,2,3-дитиазолов был опубликован Кимом в 1998 г.,[2] однако, он был посвящен в основном химии соли Аппеля и охватывал далеко не все аспекты этого класса соединений. Более основательно свойства 1,2,3-дитиазолов рассмотрены в главе монографии Comprehensive Heterocyclic Chemistry II.[3]
Методы синтеза
Соли 1,2,3-дитиазолия
Наиболее важное и интенсивно исследующееся до настоящего времени соединение класса 1,2,3-дитиазолов – соль Аппеля 1а была впервые получена реакцией ацетонитрила с монохлоридом серы и описана как нестабильный 2,3,4-трихлор-1,2,3-дитиазол.[4] Позднее Аппель и соавторы выделили это соединение при реакции хлорацетонитрила с S2Cl2 в хлористом метилене, и эта методика является наиболее удобным методом синтеза соединения 1а. Соль Аппеля может быть также получена при взаимодействии монохлорида серы с этиламином, но выход конечного продукта и условия реакции не раскрываются.[5] Недавно ряд монозамещенных ацетонитрилов был превращен в хлориды 5-R-4-хлор-1,2,3-дитиазолия 1 (Схема 1).[6,7]
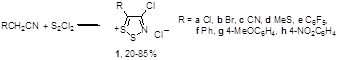
Схема 1
Для превращения замещенных ацетонитрилов в соли 1,2,3-дитиазолия были предложены различные механизмы, однако строгих доказательств пока не получено. Можно предположить, что первой стадией этого превращения является хлорирование ацетонитрила монохлоридом серы до α-хлорацетонитрилов 5, как это продемонстрировано для ацетонитрила [1] и для фенилацетонитрила.[8] Далее, по-видимому, может происходить присоединение S2Cl2 к нитрильной группе, циклизация и ионизация дитиазола (Схема 2).
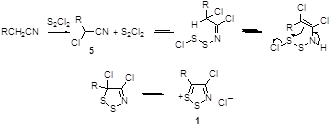
Схема 2
Нитрил глутаровой кислоты реагирует с монохлоридом серы, образуя хлорид изотиазолилдитиазолия 6 (Схема 3); механизм этой интересной перегруппировки не приводится.[9]
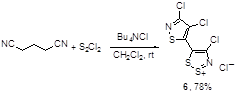
Схема 3
Возможность синтеза хлоридов 4-замещенных 5-хлор-1,2,3-дитиазолия 7 была продемонстрирована на реакциях оксимов ацетофенона и его 4-нитропроизводного с S2Cl2 (Схема 4).[10, 11]
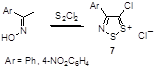
Схема 4
И, наконец, полифторалкильные производные этих солей 8 были успешно и с высокими выходами получены при взаимодействии соответствующих енаминов 9 с S2Cl2 (Схема 5).[12]
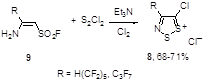
Схема 5
Наиболее известным методом синтеза 1,2,3-дитиазолов, конденсированных с бензольным кольцом, является реакция ароматических аминов с монохлоридом серы. Несмотря на то, что она известна более 80 лет, превращения этого типа активно изучаются до сих пор. Ранние результаты исследований в этой области собраны в обзоре 1957 г. [13] и в данном обзоре рассматривается лишь синтез 1,2,3-дитиазолов, конденсированных с другими гетероциклами и соединений, содержащих два дитиазольных кольца, синтезу и свойствам которых уделяется пристальное внимание в последние годы.
Важным достижением так называемой «двойной конденсации по Герцу» (“double Herz condensation) является синтез дихлоридов нафто-бис[1,2,3]дитиазолия 10 реакцией 2,6-диаминонафталина с монохлоридом серы (Схема 6).[14]
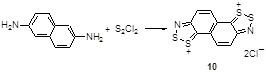
Схема 6
N-Алкилпроизводные солей 2,6-диаминопиридинов также легко превращаются в соли бис[1,2,3]дитиазолопиридиния 11 (Схема 7).[15]
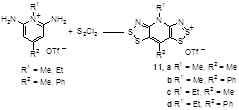
Схема 7
Если в реакцию вводятся пиридиниевые соли 12, незамещенные в 4-положении, то образование солей бис-дитиазолия 13 сопровождается одновременным хлорированием (Схема 8).[16, 17]
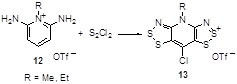
Схема 8
Описано несколько примеров превращений для соединений, в которых аминогруппа находится при тиофеновом цикле, причем тиенодитиазолиевые соли 14 и 15 могут образовываться даже в том случае, когда карбоксигруппа находится в орто-положении к аминогруппе в гетероцикле (Схема 9).[18, 19]
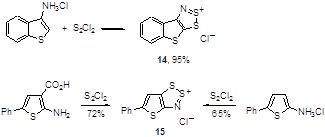
Схема 9
Предложен двухстадийный метод синтеза хлорида хиноксалино-1,2,3-дитиазолия 16 взаимодействием хиноксалинаминотиола 17 со смесью монохлорида серы и хлора с последующей обработкой продукта реакции 18 S2Cl2 (Схема 10).[20]
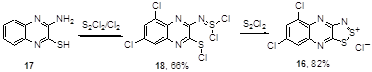
Схема 10
|
из
5.00
|
Обсуждение в статье: Синтез и свойства 1,2,3-дитиазолов. Литературный обзор |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

