 |
Главная |
Нуклеофильная атака по атому углерода гетероцикла
|
из
5.00
|
N-Монозамещенные о-фенилендиамины реагируют с солью Аппеля 1а в хлористом метилене при комнатной температуре с образованием 2-цианобензимидазолов 132 путем термической или катализируемой кислотами перегруппировки промежуточно образующихся имино-1,2,3-дитиазолов 133, которые могут быть выделены из реакционной среды.[65] Механизм этой перегруппировки включает обратимую атаку о-аминогруппы по атому углерода кольца с образованием спиросоединения 134, которое ароматизируется с элиминированием хлористого водорода и молекулы двухатомной серы (Схема 71).

Схема 71
Образование двухатомной серы, S2, зафиксировано получением соответствующих циклоаддуктов в реакции с норборненом и 2,3-дифенилбутадиеном.[65]
Реакция имина 110, полученного из метилового эфира антраниловой кислоты и соли Аппеля, с первичными алкиламинами в тетрагидрофуране при комнатной температуре приводит к 3-алкил-2-цианохиназолин-4(3Н)-онам 135 с высокими выходами.[66] Аналогичным образом были получены 3-алкил-2-цианотиенил[3,2-d]пиримидин-4(3Н)-оны 136 из соответствующих иминов на основе 2-аминотиофенкарбоксилатов 137 (Схема 72).[66, 67]

Схема 72
Производные антраниловых кислот, содержащие в сложноэфирной группе полимерные остатки, были превращены в производные 2-цианохиназолин-4(3Н)-онов реакцией с солью Аппеля и затем с широким кругом алифатических аминов с выходами, близкими к количественным.[68]
Менее нуклеофильные ароматические амины не реагируют с арилиминами 138 даже при температуре кипения растворителя (тетрагидрофурана). Однако, активация положения С-5 дитиазольного цикла кислотой Льюиса, например, четыреххлористым титаном, приводит к получению 4-гидрокси-4-фенилхиназолинов 139 с высокими выходами (58-83%).[69] ЯМР спектры растворов этих соединений в дейтерохлороформе показали, что они существуют в виде равновесной смеси с соответствующими N-(2-бензоиларил)-2-цианамидинами 140 (Схема 73).

Схема 73
Механизм этих превращений включает нуклеофильную атаку первичной аминогруппы на атом углерода С-5 имина с последующим элиминированием молекул хлористого водорода и S2 и замыканием цианоамидинового фрагмента в хиназолиновый цикл.[69]
Реакция иминов 141, полученных из замещенных антранилатов, с этилендиамином приводит к редко встречающимся, однако важным в биологическом отношении, трициклическим 3,3-дигидро-2Н-пиразино[2,1-b]хиназолинам 142 (Схема 74).[70]
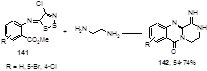
Схема 74
Взаимодействие имина 110 с другим диамином - о-фенилендиамином в тетрагидрофуране при комнатной температуре привело к смеси ожидаемого хиназолинона 143 и производному 2-аминохиноксалина 144 (Схема 75).[71]
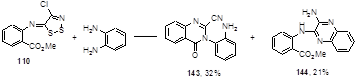
Схема 75
Оба продукта реакции являются следствием атаки молекулы диамина на атом углерода С-5 дитиазольного цикла с образованием 2-цианохиназолина 143 или 2-цианамидина типа 140, который под действием второй молекулы о-фенилендиамина циклизуется в пиразин 144.
Взаимодействие замещенных иминов 141 с о-аминобензиламином начинается главным образом с атаки алифатического амина по атому серы 1,2,3-дитиазольного цикла с образованием цианотиоформамидинов 145 (выходы 47-68%), и лишь частично - по атому углерода цикла, с образованием новой тетрациклической системы 146, очевидно, через промежуточное образование 2-цианохиназолинона 147 (Схема 76).[71]

Схема 76
Обработка имино 1,2,3-дитиазола 137, полученного из соли Аппеля и метилового эфира 3-амино-2-тиофенкарбоновой кислоты, о-аминобензиламином в тетрагидрофуране привела к получению новой гетероциклической системы 148, в которой тиенопиримидиновое кольцо сконденсировано с хиназолиновым фрагментом.[72] В качестве основного продукта этой реакции был выделен цианотиоформамид 149 (Схема 77), образование которого является результатом двух нуклеофильных атак алифатической части диамина по атому серы иминодитиазольного цикла по механизму, который был приведен выше.

Схема 77
Менее нуклеофильный о-фенилендиамин не реагирует с имином 137.
Обработка иминодитиазола 150, содержащего нитрильную группу в о-положении к иминогруппе, щелочью в спирте дает хиназолин-2-карбонитрилы 151, в ряде случаев с хорошими выходами (до 82%) (Схема 78).[73] Предполагаемый механизм основывается на присоединении алкокси-аниона к нитрильной группе с последующей циклизацией и отщеплением молекул хлористого водорода и двухатомной серы.
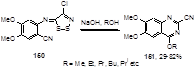
Схема 78
Реакция 5-арилимино-1,2,3-дитиазолов 19 с гидроксиламином протекает легко, давая N-арилцианоформамидоксимы 152 (Схема 79), которые могут быть использованы как исходные соединения для синтеза 4-замещенных 2-цианохиназолинов и 4-арил-3-циан-1,2,4-оксадиазин-5(6Н)-онов.[74]

Схема 79
Если в орто-положении ароматического кольца находится ацетильная или бензоильная группы (153), то в аналогичных условиях образуются 3-оксиды 2-цианохиназолинонов 154 с выходами от средних до высоких (Схема 80).[74]

Схема 80
Термолиз
N-Арилимино-1,2,3-дитиазолы 19 при нагревании легко образуют 2-цианобензотиазолы 155, что является простым двухстадийным методом синтеза этих гетероциклов из соответствующих ароматических аминов.[21, 31] Электронодонорные заместители в анилиновом кольце способствуют этому превращению, а электроноакцепторные замедляют его, при этом происходит побочная реакция – потеря обоих атомов серы дитиазольного цикла и образование цианимидоил хлоридов 156 (Схема 81).

Схема 81
Если оба ортоположения бензольного кольца замещены, то соединения 156 являются единственными продуктами реакции (Ar = 2,4,6-Me3C6H2 (22%), 2,4,6-Et3C6H2 (31%)).[21] Арилимины 19, содержащие атомы фтора в ароматическом кольце, также образуют смеси бензотиазолов 155 и имидоил хлоридов 156.[75] Атомы фтора оказались недостаточно электроноакцепторными заместителями, чтобы образование имидоил хлоридов стало основным направлением реакции; их выходы не превышали 20% (Ar = 4-F C6H4, 2,4-F2C6H3, 3,4-F2C6H3).
Циклизация иминов 19 в 2-цианобензотиазолы 155 может происходить при облучении в микроволновой печи в таком высококипящем растворителе, как N-метилпирролидин-2-он при 150 °С, а также в экологически чистом процессе без растворителя в присутствии графита при той же температуре.[76] Выходы, также как и в обычных условиях, остаются средними (45-52%).
N-Алкилимины часто разлагают при более низкой температуре. При нагревании до 150 °С в запаянной трубке с 2,3-дифенил- и 2,3-диметилбутадиенами метилимин 157 образует известные продукты реакции Дильса-Альдера двухатомной синглетной серы, S2, 1,2-дитиины 158. В этих же условиях норборнен дает трисульфид 159 (62%) (Схема 82).[21] Необходимо отметить, что эти соединения не образуются при нагревании элементной серы с алкенами в аналогичных условиях.

Схема 82
Нагревание о-бромфенильных производных иминов 160 в присутствии одноиодистой меди в кипящем пиридине приводит к 2-цианобензотиазолам 155 с хорошими выходами (58-84%).[77] Проведение этой реакции в микроволновом реакторе привело к снижению времени реакции без потери в выходах конечных продуктов (61-87%) (Схема 83). Предполагается, что процессам отщепления двухатомной серы и циклизации в тиазольное кольцо способствует образование комплекса между атомом галогена (брома) и одновалентной медью.
 Схема 83
Схема 83
Используя аналогичный метод удалось получить ряд цианозамещенных тиазолобензотриазолов 161,[78] и изомеров тиазолохиназолинонов 162, 163 (Схема 84),[79] которые замедляют рост раковых клеток.[80]

Схема 84
Термолиз имино-1,2,3-дитиазолов 164, полученных из соли Аппеля 1а и 8-аминохинолинов, в течение 1 мин при 200 °С неожиданно приводит к имидазохинолинтионам 165 с выходами 25-49%.[81, 82] Механизм этой необычной перегруппировки предполагает участие близлежащего атом азота хинолинового цикла в образовании имидазохинолина 166, который циклизуется в тетрациклическую структуру 167. Выделение хлористого водорода и потеря одного атома серы семичленного кольца в соединении 167, возможно через промежуточный нитрилсульфид, приводит к конечному продукту 165 (Схема 85).

Схема 85
Термолиз (о-гидроксифенил)имина 168 протекает с выделением двух атомов серы и хлористого водорода, предположительно через промежуточное спиросоединение 169, и приводит к 2-цианобензоксазолу 170 с высоким выходом (Схема 86).[31]

Схема 86
|
из
5.00
|
Обсуждение в статье: Нуклеофильная атака по атому углерода гетероцикла |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

