 |
Главная |
Нуклеофильная атака на атомы серы дитиазольного цикла
|
из
5.00
|
Различные нуклеофильные реагенты могут атаковать атомы серы S-1 и S-2 1,2,3-дитиазольного цикла. Результатом этих реакций является образование серасодержащих гетероциклов при атаке атома серы S-1 или образование соединений с тионной группой при атаке атома серы S-2.
Неизвестные ранее 4-оксиды 1,2,4-тиадиазола 90 были получены при конденсации бензамидоксимов или их производных с солью Аппеля 1а.[49] Механизм реакции включает в себя атаку иминогруппы в промежуточно образующемся иминодитиазоле 91 на S-1 атом дитиазольного цикла. Структура 4-оксидов была подтверждена с помощью анализа масс- и ЯМР спектров 15N-обогащенного и обычного продуктов реакции и рентгеноструктурным анализом карбоксамида 92, который был получен гидролизом нитрила 90а (Схема 52).[50]

Схема 52
Метил 3-аминокротонат 93 реагирует с солью Аппеля, давая изотиазол 94 с высоким выходом.[51] Спонтанное превращение предполагаемого интермедиата 95 в изотиазол также подразумевает нуклеофильную атаку по атому серы S-1 гетероцикла (Схема 53).

Схема 53
Авторы рассматривают эту реакцию, как один из вариантов перегруппировки Боултона-Катрицкого, в которой трехатомная боковая цепь атакует пятичленное гетероциклическое кольцо с его раскрытием и образованием нового пятичленного гетероцикла. Примечательно, что эта перегруппировка протекает в необычно мягких условиях, чему способствуют легкий разрыв S-S связи в 1,2,3-дитиазольном кольце, ароматичность образующегося изотиазольного цикла и образование устойчивой нитрильной группы.[51]
Различные реагенты с нуклеофильной или восстанавливающей способностью могут атаковать атом серы S-2 дитиазольного кольца. Обработка арилиминов 96 гидроокисью натрия в водном этаноле приводит к тиокарбамоиламидинам 97 с высокими выходами (Схема 54).[52] Образование амидинов объясняется нуклеофильной атакой гидроксид-аниона по атому S-2 с последующим разрывом S-S связи дитиазольного цикла.

Схема 54
Кипячение 4-хлор-5-(2-гидроксиметилариламино)-5Н-1,2,3-дитиазолов 98 с гидридом натрия в тетрагидрофуране приводит к смеси бензоксазинов 99 (29-71%), бензотиазинов 100 (5-10%) и бензоксазин-2-тионов 101 (0-49%) (Схема 55).[53]

Схема 55
Образование основного продукта реакции - бензоксазина 99 можно представить скорее всего как нуклеофильную атаку алкоксидного аниона, который образуется из молекулы бензилового спирта и гидрида натрия, на иминный атом углерода с последующим элиминированием молекулы двухатомной серы (S2) (Схема 56).

Схема 56
Дигидро-3,1-бензоксазепин 102, структурно близкий к бензоксазинам 99, был синтезирован с 71%-ным выходом из имина 103 и гидрида натрия (Схема 57).[54]
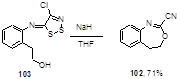
Схема 57
Нуклеофильная атака гидрид-иона по атому серы S-2 с последующим размыканием дитиазольного цикла приводит к N-(2-гидроксиметиларил)цианотиоформамиду, который после потери HCN может образовывать 2-(гидроксиметил)арил изотиоцианат 104. Внутримолекулярная циклизация этого продукта дает бензоксазин-2-тион 101 (Схема 58).

Схема 58
Образование бензотиазина 100, как предполагают, может включать нуклеофильную атаку гидрид-иона по атому серы S-2 с последующим раскрытием дитиазольного цикла. Дальнейшее выделение сероводорода и воды и внутримолекулярная циклизация 105 приводят к бензотиазину 100 (Схема 59).

Схема 59
Трифенилфосфин и фосфониевые илиды известны как удобные реагенты для извлечения атома серы из органических соединений. Реакция 4-хлорзамещенных N-арилимино-1,2,3-дитиазолов 19 с трифенилфосфином (2 эквивалента) во влажном хлористом метилене приводит к N-арилцианотиоформамидинам 106 c хорошими выходами, одновременно с почти количественными выходами образуются трифенилфосфин оксид и сульфид.[55, 56] Данное превращение объясняется авторами как нуклеофильная атака молекулы трифенилфосфина по атому серы S-2 имина 19 с образованием тиоамид-иона 107 с последующей его атакой второй молекулой трифенилфосфина по тому же атому серы с образованием стабилизированного цианотиоформамидного ариона 108 и дикатиона 109, гидролиз которого приводит к Ph3PS и Ph3PO (Схема 60).
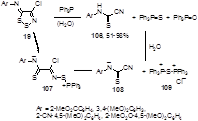
Схема 60
Имин 110, полученный из соли Аппеля 1а и антраниловой кислоты (без добавления пиридина на последней стадии), образует в реакции с трифенилфосфином 2-циан-3,1-бензотиазин-4-он 100 с количественным выходом.[56] Предполагается, что имин 110 образует в реакции с Ph3P тиоамид-анион 111, который может присоединять дикатион 109 с образованием промежуточного соединения 112, которое циклизуется, давая бензотиазинон 100 и другие продукты реакции (Схема 61).

Схема 61
Аналогично реагирует с Ph3P имин 113, синтезированный из 3-амино-2-нафталинкабоновой кислоты (выход тиазинона 114 составил 24%) (Схема 62).
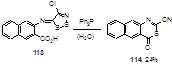
Схема 62
4-Аминозамещенные имино-1,2,3-дитиазолы 96 реагируют с трифенилфосфином во влажном хлористом метилене так же как и имины 19, давая N-арилцианотиоформамидины 106.[57] Эти соединения также могут быть получены из иминов и стабильных фосфоранов 115 (Схема 63). Однако, основными продуктами данной реакции являются дитиометиленфосфораны 116, что однозначно подтверждает первичную атаку по атому S-2 гетероцикла.[58]

Схема 63
При действии реактива Гриньяра на имин 117 также происходит раскрытие 1,2,3-дитиазольного кольца, которое, по-видимому, начинается с атаки по атому серы S-2 гетероцикла. Добавление второго моля реактива Гриньяра в реакционную смесь приводит к образованию арилизотиоцианата 118 (Схема 64).[59]

Схема 64
Вторичные амины могут легко раскрывать дитиазольный цикл; одним из примеров такой реакции является первоначальная атака по атому серы с перегруппировкой изоксазолилимино-1,2,3-дитиазолов 119 в цианотиадиазолы 120 при реакции с пиперидином (Схема 65).[60]
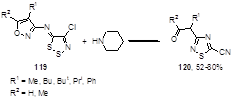
Схема 65
При кипячении 4-хлор-5-(4-тозилсульфонилимино)-5Н-1,2,3-дитиазола 121 в диметилформамиде образуются элементная сера (19%) и N'-(4-толилсульфонил)-N,N-диметилцианоформамидин 122 (64%) (Схема 66).[61]

Схема 66
Выделение этого продукта позволило предположить, что диметиламин, образующийся при разложении ДМФА при высокой температуре, принимает непосредственное участие в реакции с имином 121. Действительно, было установлено, что диметиламин, как и другие первичные и вторичные амины, образуют в реакции с имином 121 при комнатной температуре цианоформамидины 123 с хорошими выходами (53-79%).[62]
Наиболее вероятный механизм образования амидинов 123 включает в себя атаку амина по атому серы S-2 1,2,3-дитиазольного цикла с образованием дисульфида 124 и последующее присоединение второй молекулы амина по иминному атому углерода с отщеплением двухатомной серы и молекулы амина, присоединенной к атому серы (Схема 67).
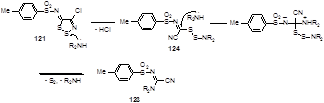
Схема 67
Промежуточное образование дисульфидов типа 124 было доказано их выделением из реакции арилиминодитиолов 117 с различными алкиламинами. Взаимодействие иминов 117 с первичными и вторичными алкиламинами при комнатной температуре приводит к смеси дисульфидов 125 и формамидинов 126 (Схема 68).[62]
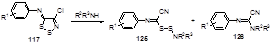
Схема 68
Таблица 1 Реакция арилимино-1,2.3-дитиазолов 117 с первичными и вторичными аминами
| № | R1 | Амин (количество эквивалентов) | Выход, % | ||
| 117 | 125 | 126 | |||
| 1 | 4-OMe | Пиперидин (2.05) | 0 | 53 | 32 |
| 2 | 4-OMe | Пирролидин (2.02) | 0 | 65 | 0 |
| 3 | 4-OMe | Пирролидин (3.84) | 0 | 0 | 88 |
| 4 | 4-OMe | Изопропиламин (2.02) | 55 | 14 | 0 |
| 5 | 4-OMe | Морфолин (4.50) | 0 | 0 | 87 |
| 6 | 4-Me | Пиперидин (2.96) | 0 | 0 | 49 |
| 7 | 4-Me | Пирролидин (2.90) | 0 | 0 | 84 |
| 8 | 4-Me | Изопропиламин (2.21) | 49 | 23 | 0 |
| 9 | 4-Me | Морфолин (2.94) | 0 | 0 | 77 |
| 10 | 4-NO2 | Пиперидин (4.10) | 0 | 47 | 47 |
| 11 | 4-NO2 | Пирролидин (2.20) | 0 | 0 | 18 |
| 12 | 4-NO2 | Диэтиламин (7.92) | 0 | 0 | 48 |
| 13 | 4-NO2 | Изопропиламин (2.13) | 47 | 0 | 0 |
| 14 | 4-NO2 | трет-Бутиламин (3.92) | 14 | 0 | 0 |
| 15 | 3-NO2 | Пиперидин (5.84) | 0 | 0 | 26 |
Реакция иминов 117 оказалась чувствительной к стерическим факторам алкиламинов, так примерно половина исходного имина 117 была возвращена из реакции с изопропиламином (примеры 4 и 8), а дисульфид 125 совсем не образуется в реакции с трет-бутиламином (пример 14). В некоторых случаях дисульфид 125 не удается зафиксировать в реакционной среде из-за его быстрого превращения в амидин 126 (см. примеры 6, 7, 9). Вывод о том, что дисульфиды 125 являются промежуточными продуктами для амидинов 126 подтверждается и тем, что выход цианоформамидинов возрастает при уменьшении количества дисульфида. И, наконец, окончательное подтверждение эта гипотеза получила в реакции некоторых дисульфидов 125 с первичными и вторичными аминами, из которых амидины 126 были выделены с выходами до 97%.
Реакция имино-1,2,3-дитиазолов 117 с избытком диалкиламина при комнатной температуре приводит к 4-диалкиламино-5-арилимино-5Н-1,2,3-дитиазолам 96 (Схема 69).[63]

Схема 69
Выходы дитиазолов 96 зависят, как от природы заместителя в фенильном кольце, так и от длины алкильного заместителя у амина. Для реакции соединения 117 (Ar = 2-Cl-5-NO2C6H4) с диэтиламином соответствующий дисульфид 125 был выделен и введен в реакцию с избытком диэтиламина при комнатной температуре, что привело к образованию 4-диалкиламинодитиазола 96 с 26%-ным выходом. Исследование УФ-спектров реакционной массы во времени показало, что стадия превращения имина 117 в дисульфид 125 проходит быстро, за ней следует медленное замыкание нового дитиазольного цикла с образованием 4-диалкиламинопроизводного 96.
Соль Аппеля 1а реагирует с 5-аминопиразолами 127 при комнатной температуре в присутствии 2,6-диметилпиридина, давая, неожиданно, конденсированные 1Н-пиразоло[3,4-d]тиазолы 128.[64] Авторы предполагают, что бициклические соединения образуются в результате спонтанной внутримолекулярной циклизации иминов 129 через промежуточно образующийся интермедиат 130, который в дальнейшем теряет атом серы и хлористый водород (Схема 70).
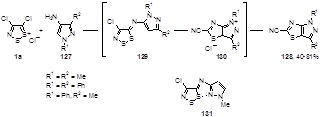
Схема 70
Очевидно, енаминная часть промежуточного соединения 129 является ответственной за легкость внутримолекулярной циклизации, поскольку имин 131, образующийся из соли Аппеля и 3-амино-1-метилпиразола не дает бициклический 2Н-пиразоло[3,4-d]тиазол по схожему механизму. Термическая стабильность имина 131 объясняется внутримолекулярным взаимодействием S…N, которое стабилизирует молекулу в конформации, препятствующей внутримолекулярной циклизации.[64]
|
из
5.00
|
Обсуждение в статье: Нуклеофильная атака на атомы серы дитиазольного цикла |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

