 |
Главная |
Задачи для самостоятельного решения
|
из
5.00
|
ЗАДАЧИ И УПРАЖНЕНИЯ
ДЛЯ ЗАОЧНОЙ ШКОЛЫ «ЮНЫЙ ХИМИК»
9–11 классы
Учебно-методическое пособие
ИЗДАТЕЛЬСТВО ТОМСКОГО УНИВЕРСИТЕТА
2007
УДК 54(076.1):087.5
ББК 24
М71
Мишенина Л.Н., Кузнецова С.А., Цыро Л.В.
М71 Задачи и упражнения для заочной школы «Юный химик». 9–11 классы: Учеб.-мет. пособие. – Томск: Изд-во Том. ун-та, 2007. – 85 с.
ISBN 2-1211-1007-2
Учебно-методическое пособие предназначено для учащихся 9–11 классов средних общеобразовательных школ по профилю «химия». В пособии содержится большое количество задач, которые позволяют учащимся закрепить знания, полученные во время теоретических занятий. Задачи подобраны в виде индивидуальных заданий, содержащих по 4 варианта.
В течение обучения учащимся заочной школы «Юный химик» предлагается выполнение 3 заданий. Для успешного выполнения заданий необходимо тщательно проработать теоретический материал. Критерий его усвоения – это умение применять полученные знания при решении качественных и расчетных задач.
Учебно-методическое пособие может быть использовано для подготовки к химическим олимпиадам различного уровня.
УДК 543(076.1):087.5
ББК 24
Рецензент:
Батырева В.А., канд. хим. наук, доцент
ISBN 2-1211-1007-2 ©Томский государственный университет
СОДЕРЖАНИЕ
ЗАДАНИЯ ДЛЯ УЧАЩИХСЯ 9 КЛАССА.. ………………………………………………….4
ЗАДАНИЕ 1. ………………………………………………………………………………….4
Примеры решения задач. 4
Задачи для самостоятельного решения. 8
ЗАДАНИЕ 2. ………………………………………………………………………………...10
Примеры решения задач. 10
Задачи для самостоятельного решения. 17
ЗАДАНИЕ 3. ………………………………………………………………………………...20
Примеры решения задач. 20
Задачи для самостоятельного решения. 26
ЗАДАНИЯ ДЛЯ УЧАЩИХСЯ 10 КЛАССА.. ……………………………………………….31
ЗАДАНИЕ 1. ………………………………………………………………………………...31
Примеры решения задач. 31
Задачи для самостоятельного решения. 35
ЗАДАНИЕ 2. ………………………………………………………………………………...37
Примеры решения задач. 38
Задачи для самостоятельного решения. 41
ЗАДАНИЕ 3. ………………………………………………………………………………...44
Примеры решения задач. 44
Задачи для самостоятельного решения. 48
ЗАДАНИЯ ДЛЯ УЧАЩИХСЯ 11 КЛАССА.. ……………………………………………….53
ЗАДАНИЕ 1. ………………………………………………………………………………...53
Примеры решения задач. 53
Задачи для самостоятельного решения. 58
ЗАДАНИЕ 2. ………………………………………………………………………………...60
Примеры решения задач. 60
Задачи для самостоятельного решения. 66
ЗАДАНИЕ 3. ………………………………………………………………………………...70
Примеры решения задач. …………………………………………………………………..70
Задачи для самостоятельного решения. 78
СПИСОК ИСПОЛЬЗУЕМЫХ ОБОЗНАЧЕНИЙ.. ………………………………………...83
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ... …………………………………………...84
ЗАДАНИЯ ДЛЯ УЧАЩИХСЯ 9 КЛАССА
ЗАДАНИЕ 1
Задание включает материал по химии элементов по теме «Водород. Галогены», а также по общей химии по темам «Растворы. Способы выражения содержания растворенного вещества», «Электролитическая диссоциация». Для выполнения задания необходимо рассмотреть химию водорода и элементов семнадцатой группы периодической системы химических элементов Д.И. Менделеева, ознакомиться с понятиями «массовая доля растворенного вещества» и «молярная концентрация», изучить теорию электролитической диссоциации, вспомнить основные понятия химии и расчеты по уравнениям химических реакций.
Примеры решения задач
Пример 1.
Колба с 250 г хлорной воды выставлена на солнечный свет. Выделившийся газ собран, его объем оказался равным 0,112 л (н. у.). Какова концентрация исходного раствора хлора (в % по массе)? Какой газ выделился из хлорной воды?
Дано:
m (хл. в.) = 250 г
V (газ) = 0,112 л (н. у.)
M (Cl2) = 71 г/моль
Найти:
w (Cl2)
Решение:
При растворении хлора в воде происходит образование хлорноватистой кислоты:
Cl2 (г) + 2H2O (ж) ⇄ Cl- (водн.) + Н3О+ (водн.) + HClO (водн.).
На свету хлорноватистая кислота разлагается с образованием газообразного кислорода:
2HClO (водн.) = 2Cl- (водн.) + Н+ (водн.) + O2 (газ).
Суммарное уравнение процесса имеет вид:
2Cl2 (г) + 2H2O (ж) = 4Cl- (водн.) + 4Н+ (водн.) + O2 (газ).
Рассчитаем количество выделившегося кислорода:
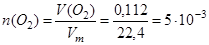 (моль).
(моль).
По уравнению реакции 1 моль кислорода соответствует 2 молям хлора, следовательно, количество прореагировавшего хлора равно 0,01 моль (5 10-3 × 2). Тогда масса хлора составляет:
m = M × n = 35,5 × 0,01 = 0,71 (г).
Если принять, что весь хлор, содержащийся в хлорной воде, прореагировал, то массовая доля хлора равна:
 (%).
(%).
Ответ: w (Cl2) = 0,28 %, выделившийся газ – кислород.
Пример 2.
Твердое кристаллическое соединение, состоящее из одновалентного металла и одновалентного неметалла, энергично реагирует с водой и водными растворами кислот с выделением водорода. При взаимодействии с водой этого вещества массой 2,4 г выделился водород объемом 2630 мл, измеренный при 37 °С и давлении 9,8×104 Па, а раствор приобрел щелочную реакцию. Определите состав вещества и напишите уравнения реакций его взаимодействия с водой и соляной кислотой.
Дано:
m (MЭ) = 2,4 г (М – металл, Э – неметалл)
V (Н2) = 2630 мл = 2,63 л
t = 37 °С (T = 310 K)
p = 9,8×104 Па
Найти:
MЭ
Решение:
Э – водород, поскольку только гидриды металлов реагируют с водой и кислотами с выделением водорода. Для определения металла необходимо вычислить молярную массу гидрида.
Определим количество выделившегося водорода. Сначала приведем объем газа к нормальным условиям:
 , следовательно,
, следовательно,  (л).
(л).
Рассчитаем количество выделившегося газа:
 (моль).
(моль).
Запишем уравнение реакции взаимодействия гидрида одновалентного металла с водой:
MH + H2O = MOH + H2.
По уравнению реакции 1 моль водорода соответствует 1 молю гидрида, следовательно, в реакцию вступил 1 моль МН.
Вычислим молярную массу гидрида:
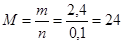 (г/моль).
(г/моль).
Атомная масса водорода равна 1 г/моль, поэтому атомная масса металла равна 23 г/моль (24 – 1). Этот металл – натрий.
Искомое вещество гидрид натрия – NaH.
Уравнения взаимодействия:
NaH + H2O = NaOH + H2
NaH + HCl = NaCl + H2
Пример 3.
Какой объем раствора с массовой долей серной кислоты 9,3 % (плотность 1,05 г/мл) потребуется для приготовления раствора 0,35 моль/л серной кислоты объемом 40 мл?
Дано:
w (H2SO4) = 9,3 %
r = 1,05 г/мл
СМ = 0,35 моль/л
V = 40 мл
M (H2SO4) = 98 г/моль
Найти:
V (р-ра)
Решение:
Вычислим количество вещества серной кислоты, необходимое для приготовления 40 мл 0,35 моль/л раствора. По определению молярной концентрации в 1 л (1000 мл) раствора содержится 0,35 моль серной кислоты, тогда:
0,35 моль – 1000 мл
n моль – 40 мл,
 (моль),
(моль),
то есть для приготовления раствора нужно взять 0,014 моль кислоты.
Вычислим массу 0,014 моль серной кислоты:
m = n × M = 0,014 × 98 = 1,37 (г)
Определим массу 9,3 %-ного раствора, содержащего 1,37 г серной кислоты:
 , тогда
, тогда
 (г).
(г).
Вычислим объем раствора:
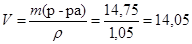 (мл).
(мл).
Ответ: V (р-ра) = 14,05 мл.
Пример 4.
Составьте уравнения реакций, протекающих с участием водных растворов электролитов, в молекулярной, ионной и сокращенной ионной формах:
а) между оксидом углерода (IV) и гидроксидом бария;
б) между оксидом кальция и хлороводородной кислотой;
в) между силикатом натрия и хлороводородной кислотой;
г) между иодидом калия и нитратом свинца (II);
д) между сульфидом железа (II) и серной кислотой.
Решение:
а) взаимодействие между оксидом углерода (IV) и гидроксидом бария:
молекулярная форма:
CO2 + Ba(OH)2 = BaCO3 + H2O;
ионная форма:
CO2 + Ba2+ + 2OH- = BaCO3 + H2O;
сокращенная ионная форма:
CO2 + Ba2+ + 2OH- = BaCO3 + H2O.
б) взаимодействие между оксидом кальция и хлороводородной кислотой:
молекулярная форма:
CaO + 2HCl = CaCl2 + H2O;
ионная форма:
CaO + 2H+ + 2Cl- = Ca2+ + 2Cl- + H2O;
сокращенная ионная форма:
CaO + 2H+ = Ca2+ + H2O.
в) взаимодействие между силикатом натрия и хлороводородной кислотой:
молекулярная форма:
Na2SiO3 + 2HCl = H2SiO3 + 2NaCl;
ионная форма:
2Na+ + SiO32- + 2H+ + 2Cl- = H2SiO3 + 2Na+ + 2Cl-;
сокращенная ионная форма:
SiO32- + 2H+ = H2SiO3.
г) взаимодействие между иодидом калия и нитратом свинца (II):
молекулярная форма:
2KI + Pb(NO3)2 = PbI2 + 2KNO3;
ионная форма:
2K+ + 2I- + Pb2+ + 2NO3- = PbI2 + 2K+ + 2NO3-;
сокращенная ионная форма:
2I- + Pb2+ = PbI2.
возможно:
PbI2 + 2KI = K2[PbI4], то есть:
молекулярная форма:
4KI + Pb(NO3)2 = K2[PbI4] + 2KNO3;
ионная форма:
4K+ + 4I- + Pb2+ + 2NO3- = [PbI4]2- + 4K+ + 2NO3-;
сокращенная ионная форма:
4I- + Pb2+ = [PbI4]2-.
д) взаимодействие между сульфидом железа (II) и серной кислотой:
молекулярная форма:
FeS + H2SO4 = FeSO4 + H2S;
ионная форма:
FeS + 2H+ + SO42- = Fe2+ + SO42- + H2S;
сокращенная ионная форма:
FeS + 2H+ = Fe2+ + H2S.
Задачи для самостоятельного решения
Вариант 1
1. Охарактеризуйте элемент фтор, для этого укажите:
- положение фтора в периодической системе Д.И. Менделеева, электронную формулу атома фтора;
- распространенность фтора в природе, изотопы фтора;
- возможные степени окисления (привести примеры соединений);
- строение молекулы фтора;
- физические свойства молекулярного фтора;
- химические свойства молекулярного фтора;
- важнейшие соединения фтора и их свойства;
- получение фтора в лаборатории и промышленности.
2. Какие объемы хлора и водорода потребуются (н. у.) для получения 1000 кг 37 % (мас.) раствора соляной кислоты?
3. Остаток, полученный после термического разложения хлората калия KClO3 в присутствии оксида марганца (IV), растворили в воде. К раствору добавили избыток раствора нитрата серебра, получив осадок массой 57,4 г. Какой объем кислорода выделился при разложении KClO3? Объем рассчитайте при н. у.
4. Как, не применяя электролиза, получить следующие соединения:
NaCl ® Cl2 ® KClO3 ® HCl ® FeCl3?
5. Какой объем раствора с массовой долей карбоната натрия 0,15 (плотность 1,16 г/мл) надо взять для приготовления раствора 0,45 моль/л Na2CO3 объемом 120 мл?
6. Могут ли одновременно быть в растворе следующие пары веществ: а) NaOH и P2O5; б) Ba(OH)2 и CO2; в) KOH и HCl; г) CuSO4 и BaCl2; д) AgNO3 и NaCl? Ответ поясните, приведите все необходимые уравнения реакций в молекулярной, ионной и сокращенной ионной формах.
Вариант 2
1. Охарактеризуйте элемент хлор, для этого укажите:
- положение хлора в периодической системе Д.И. Менделеева, электронную формулу атома хлора;
- распространенность хлора в природе, изотопы хлора;
- возможные степени окисления (привести примеры соединений);
- строение молекулы хлора;
- физические свойства молекулярного хлора;
- химические свойства молекулярного хлора;
- важнейшие соединения хлора и их свойства;
- получение хлора в лаборатории и промышленности.
2. К раствору, содержащему 1,6 г бромида калия, прибавили 5 г технического брома, содержащего примесь хлора. После упаривания смеси было получено 1,155 г твердого остатка. Определите массовую долю (в %) хлора в препарате брома.
3. Имеются две соли А и В. Одна из них А – оранжевая, хорошо растворимая в воде, ее раствор окрашивает пламя в бледно-фиолетовый цвет. Соль А – окислитель, при ее взаимодействии с восстановителем в кислой среде окраска раствора меняется на зеленовато-фиолетовую. Другая соль В – белая, при нагревании разлагается на газообразные продукты. Раствор соли при взаимодействии с нитратом серебра дает белый творожистый осадок. Соли А и В реагируют между собой. Определите, какие это соли. Рассчитайте молярный состав смеси А и В, при нагревании которой выделилось 2,24 л газа, а в продукте реакции, обработанном водой, было получено 15,2 г оксида металла (III) зеленого цвета, практически нерастворимого в воде.
4. В двух пробирках налита бромная и йодная вода. Определите опытным путем, в какой пробирке находится йодная вода.
5. Определите массовую долю хлорида кальция в растворе с концентрацией 1,4 моль/л CaCl2, плотность которого равна 1,12 г/мл.
6. Напишите в молекулярном и ионном виде уравнения всех возможных реакций между следующими веществами, взятыми попарно: оксид магния, хлороводородная кислота, сульфит натрия, хлорид кальция, нитрат серебра.
Вариант 3
1. Охарактеризуйте элемент бром, для этого укажите:
- положение брома в периодической системе Д.И. Менделеева, электронную формулу атома брома;
- распространенность хлора в природе, изотопы брома;
- возможные степени окисления (привести примеры соединений);
- строение молекулы брома;
- физические свойства молекулярного брома;
- химические свойства молекулярного брома;
- важнейшие соединения брома и их свойства;
- получение брома в лаборатории и промышленности.
2. Каменная соль одного из месторождений содержит хлорид натрия (массовая доля 96 %), хлорид кальция (0,2 %), хлорид магния (0,2 %) и другие компоненты, не содержащие хлор. Какой объем соляной кислоты с массовой долей HCl 36 % и плотностью 1,18 г/мл можно получить из образца каменной соли массой 5 кг?
3. Приведите примеры кислот одного и того же элемента Х с формулами HnXOm, HnXOm+1, HnXOm+2, HnXOm+3 (для m = n и m < n); назовите приведенные вещества, сравните силу кислот.
4. Укажите лабораторные и промышленные способы получения водорода. Назовите наиболее важные области применения водорода в промышленности.
5. В лаборатории имеется раствор хлорида калия с концентрацией 3 моль/л. Определите его объем, который потребуется для приготовления раствора объемом 200 мл с массовой долей KCl 8 % и плотностью 1,05 г/мл.
6. В четырех пробирках без надписей находятся растворы следующих веществ: сульфата натрия, карбоната натрия, нитрата натрия и йодида натрия. Укажите, с помощью каких реагентов можно определить, где какая соль находится. Напишите уравнения реакций в молекулярной и сокращенной ионной формах.
Вариант 4
1. Составьте таблицу сравнительных свойств галогенов:
| Галоген | Молекулярная формула простого вещества | Агрегатное состояние в обычных условиях | Формула водородного соединения | Возможные степени окисления в соединениях с кислородом | Формула высшего оксида |
Ответьте на вопросы:
- Как изменяются физические свойства (агрегатное состояние, цвет, температуры плавления и кипения) простых веществ галогенов с ростом относительной атомной массы соответствующих элементов. При ответе используйте различие в электронном строении атомов галогенов. Как изменяется химическая активность галогенов по отношению к водороду? Ответ поясните.
- Какова формула кислоты, соответствующей высшему оксиду хлора? Составьте уравнения реакций взаимодействия этой кислоты с веществами известных вам классов неорганических соединений (металл, оксид металла, основание, соль).
- Какими свойствами фтор выделяется среди галогенов? Приведите известные вам реакции, при помощи которых можно определить молекулярный йод и ионы галогенов.
2. Весь хлороводород, полученный действием избытка серной кислоты на хлорид калия массой 14,9 г, поглотили водой массой 200 г. Определите массовую долю хлороводорода в растворе, если его выход в реакции составил 70 %.
3. Газ А – бесцветный, с резким запахом, хорошо растворяется в воде. При действии цинка на водный раствор этого газа выделяется горючий газ В, который при пропускании над твердым веществом С черного цвета превращает его в простое вещество красного цвета Д. Что собой представляют вещества А, В, С и Д? Напишите уравнения всех реакций.
4. Укажите, в виде каких соединений хлор встречается в природе. Приведите способы лабораторного и промышленного получения хлора.
5. Вычислите, какой объем раствора хлорида натрия с концентрацией 3 моль/л плотностью 1,12 г/мл надо прилить к воде массой 200 г, чтобы получить раствор с массовой долей NaCl 10 %.
6. Укажите, с помощью каких реагентов можно различить растворы серной, азотной и соляной кислот, находящихся в трех пробирках. Напишите уравнения соответствующих реакций в молекулярной и ионной формах.
ЗАДАНИЕ 2
Задание включает материал по химии элементов «Кислород, сера», «Азот, фосфор» а также по общей химии по темам: «Растворы. Гидролиз солей», «Электролитическая диссоциация», «Химическое равновесие». Для выполнения задания необходимо рассмотреть химию элементов кислорода, серы, азота и фосфора, ознакомиться с процессами, протекающими при растворении солей в воде, вспомнить основные понятия химии, расчеты по уравнениям химических реакций, теорию электролитической диссоциации.
Примеры решения задач
Пример 1.
Укажите, какие химические процессы лежат в основе получения фосфорной кислоты. Напишите уравнения реакций получения H3РO4.
Решение:
Термический способ получения фосфорной кислоты основан на окислении элементарного фосфора в избытке воздуха с последующей гидратацией образующегося оксида фосфора (V) и конденсацией фосфорной кислоты:
4Р + 5О2 = Р4О10
nР4О10 + 2nH2O = 4(HPO3)n при 700 °С
4(HPO3)n + 2nH2O = 2nH4P2O7 при 450 °С
2nH4P2O7 + 2nH2O = 4nH3PO4 ниже 230 °С
Суммарное уравнение:
Р4О10 + 6H2O = 6H3PO4.
Также ортофосфорную кислоту получают при переработке апатитов:
Ca5(PO4)3F + 5H2SO4 + 10H2O = 5CaSO4×2H2O + 3H3PO4 + HF.
Пример 2.
К 24 %-ному раствору нитрата аммония (плотность 1,1 г/мл) объемом 45,45 мл прибавили 80 г 10 %-ного раствора гидроксида натрия. Полученный раствор быстро прокипятили (потерями паров воды пренебречь). Определите, какие вещества остались после этого в растворе, и рассчитайте их содержание (в процентах по массе).
Дано:
w (NH4NO3) = 24 %
r = 1,1 г/мл
V = 45,45 мл
m (р-ра) = 80 г
w (NaOH) = 10 %
М (NH4NO3) = 80 г/моль
М (NaOH) = 40 г/моль
M (NaNO3) = 85 г/моль
M (H2O) = 18 г/моль
Найти:
w (полученных веществ)
Решение:
Запишем уравнение реакции взаимодействия между растворами нитрата аммония и гидроксида натрия:
NH4NO3 + NaOH = NaNO3 + NH3 + H2O.
Вычислим количество вступивших в реакцию веществ. Масса раствора нитрата аммония равна:
m (р-ра) = V × r = 45,45 × 1,1 = 50 (г).
Масса нитрата аммония равна:
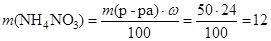 (г).
(г).
Количество вещества нитрата аммония составляет:
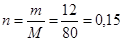 (моль).
(моль).
Масса гидроксида натрия равна:
 (г).
(г).
Количество вещества гидроксида натрия составляет:
 (моль).
(моль).
По уравнению реакции взаимодействия на 1 моль нитрата аммония приходится 1 моль гидроксида натрия. В исходной смеси содержится 0,15 моль нитрата аммония и 0,20 моль гидроксида натрия, следовательно, гидроксид натрия взят в избытке. Избыток составляет 0,20 – 0,15 = 0,05 моль или 2 г (m (NaOH) = n × M = 0,05 × 40 = 2,00 г).
Вычислим количество образовавшегося нитрата натрия. По уравнению реакции 1 моль нитрата аммония соответствует 1 молю нитрата натрия. В реакцию вступило 0,15 моль нитрата аммония, следовательно, образовалось 0,15 моль нитрата натрия или 12,75 г (m (NaNO3) = n × M = 0,15 × 85 = 12,75 г). В растворе после завершения реакции содержится 2 г гидроксида натрия и 12,75 г нитрата натрия (аммиак – газообразное вещество).
Для расчета массовой доли веществ определим массу раствора. Масса раствора после завершения реакции включает массы: воды, поступившей с раствором нитрата аммония (m1 (H2O)); воды, содержащейся в растворе гидроксида натрия (m2 (H2O)); воды, образовавшейся по реакции (m3 (H2O)); оставшегося гидроксида натрия (m (NaOH)); образовавшегося нитрата натрия (m (NaNO3)).
m1 (H2O) = m (р-ра) – m (NH4NO3) = 50 – 12 = 38 (г).
m2 (H2O) = m (р-ра) – m (NaOH) = 80 – 8 = 72 (г).
m3 (H2O) = n (H2O) × M (H2O) = 0,15 × 18 = 2,70 (г).
m (р-ра) = m1 (H2O) + m2 (H2O) + m3 (H2O) + m (NaOH) + m (NaNO3) = 38 + 72 + 2,70 + 2 + 12, 75 = 127,45 (г).
Вычислим массовые доли веществ в растворе:
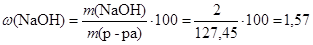 %;
%;
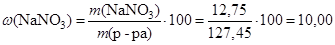 %.
%.
Ответ: w (NaOH) = 1,57 %; w (NaNO3) = 10,00 %.
Пример 3.
Назовите вещества, состоящие из трех и более элементов, каждое из которых разлагается с выделением кислорода, причем масса выделившегося кислорода составляет не менее 10 % массы разложившихся веществ.
Решение:
1) KClO3 – хлорат калия.
2KClO3 = 2KCl + 3O2
 (%).
(%).
2) KMnO4 – перманганат калия.
2KMnO4 = K2MnO4 + MnO2 + O2
 (%).
(%).
3) KNO3 – нитрат калия.
2KNO3 = 2KNO2 + O2
 (%).
(%).
Пример 4.
Напишите уравнения реакций, при помощи которых, используя простые вещества – кальций, фосфор и кислород, можно получить фосфат кальция.
Решение:
1) 4P + 5O2 = 2P2O5.
2) 2Ca + O2 = 2CaO.
3) 3CaO + P2O5 = Ca3(PO4)2.
Пример 5.
Если через смесь азота с водородом пропустить искровой разряд, то образуется лишь немного аммиака. Но если при этом газовая смесь находится над серной кислотой, то синтез идет до конца. Укажите, что является причиной такого изменения в ходе процесса.
Решение:
Уравнение реакции взаимодействия водорода и азота:
N2 + 3H2 ⇆ 2NH3.
Если газовая смесь находится над серной кислотой, то образующийся аммиак взаимодействует с серной кислотой с образованием сульфата аммония:
2NH3 + H2SO4 = (NH4)2SO4.
Аммиак покидает сферу реакции и согласно принципу Ле Шателье равновесие смещается в сторону продуктов реакции.
Пример 6.
При окислении фосфора 60 %-ным раствором азотной кислоты (плотность 1,37 г/мл) получены оксид азота (II) и ортофосфорная кислота, на нейтрализацию которой потребовалось 25 мл 25 %-ного раствора гидроксида натрия (плотность 1,28 г/мл), причем образовался дигидрофосфат натрия. Рассчитайте объем азотной кислоты, взятой для окисления фосфора, и объем выделившегося газа (при н. у.).
Дано:
w (HNO3) = 60 %
r (p-pa HNO3) = 1,37 г/мл
w (NaOH) = 25 %
r (p-pa NaOH) = 1,28 г/мл
V (p-pa NaOH) = 25 мл
М (NaOH) = 40 г/моль
М (HNO3) = 63 г/моль
Найти:
V (p-pa HNO3)
V (газа)
Решение:
Запишем уравнение реакции взаимодействия фосфора с азотной кислотой, при этом учтем, что по условию задачи образуется ортофосфорная кислота и оксид азота (II):
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO. (1)
Запишем уравнение реакции нейтрализации фосфорной кислоты гидроксидом натрия с образованием дигидрофосфата натрия:
H3PO4 + NaOH = NaH2PO4 + H2O. (2)
Для определения объема азотной кислоты, взятой для окисления фосфора, и объема выделившегося газа необходимо знать количество образовавшейся ортофосфорной кислоты. Определить это количество можно, зная количество вещества (в моль) гидроксида натрия, необходимого для реакции (2). По условию задачи даны объем раствора гидроксида натрия, пошедшего на реакцию, его плотность и массовая доля NaOH в растворе. Найдем количество вещества NaOH, исходя из этих данных.
Масса раствора связана с его объемом и плотностью соотношением:
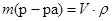 .
.
m (р-ра) = 25 × 1,28 = 32 (г).
Массу вещества найдем из определения массовой доли растворенного вещества:
 тогда
тогда
 (г);
(г);
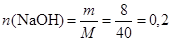 (моль).
(моль).
Количество вещества NaOH равно 0,2 моль, тогда по уравнению реакции (2) количество ортофосфорной кислоты также равно 0,2 моль (по уравнению реакции соотношение n(H3PO4) : n(NaOH) = 1 : 1).
Для расчета объема азотной кислоты необходимо знать её количество. По уравнению реакции (1) для образования 3 моль ортофосфорной кислоты необходимо 5 моль азотной кислоты, то есть соотношение n(H3PO4) : n(HNO3) = 3 : 5. По условию задачи образовалось 0,2 моль ортофосфорной кислоты, следовательно, азотной кислоты прореагировало 1/3 моль (n(HNO3) = 3/5 × n(H3PO4)).
Определим массу азотной кислоты:
m (в-ва) = n × M = 1/3 × 63 = 21 (г).
Вычислим массу раствора азотной кислоты, зная массовую долю HNO3 в растворе:
 (г).
(г).
Определим объем раствора 60 %-ной азотной кислоты необходимый для взаимодействия:
 (мл).
(мл).
Найдем объем выделившегося газа – оксида азота (II). По уравнению реакции (1) при образовании 3 моль ортофосфорной кислоты выделяется 5 моль оксида азота (II), то есть соотношение n(H3PO4) : n(NO) = 3 : 5. По условию задачи образовалось 0,2 моль ортофосфорной кислоты, значит, оксида азота (II) образовалось 1/3 моль (n(NO) = 3/5 × n(H3PO4)). Тогда:
 .
.
Зная количество вещества оксида азота (II), равное 1/3 моль, найдем его объем при нормальных условиях:
V = n × 22,4 = 7,47 (л).
Ответ: V (р-ра HNO3) = 25,5 мл; V (NO) = 7,47 л.
Пример 7.
Концентрированный водный раствор вещества Х реагирует с двумя разными твердыми веществами А и Б и образует при этом два газообразных вещества В и Г, которые при взаимодействии между собой образуют исходное вещество Х. Определите, что могут представлять собой названные вещества. Напишите уравнения соответствующих реакций.
Решение:
Взаимодействие газов В и Г может быть окислительно-восстановительным процессом или реакцией, протекающей без изменения степеней окисления.
В первом случае твердые вещества А и Б должны быть окислителем и восстановителем, тогда Х должно быть образовано элементами, входящими в состав газов, которые получаются при окислении и восстановлении Х. Веществом Х может быть хлороводород. Концентрированный водный раствор Х – соляная кислота – проявляет восстановительные свойства за счет аниона хлора и окислительные за счет катиона водорода, вещество А – окислитель, например, оксид марганца, Б – восстановитель, например, цинк.
4HCl (р-р) + MnO2 (тв.)= MnCl2 + Cl2 + 2H2O;
Х + А ® ….. В
В – газ хлор.
2HCl (р-р) + Zn (ТВ.) = ZnCl2 + H2;
Х + Б ® …… Г
Г – газ водород.
В (Cl2) и Г (H2) реагируют с образованием Х (HCl):
Cl2 + H2 = HCl.
Если процесс протекает без изменения степеней окислений, то возможно несколько вариантов решения, например:
NH4Cl (р-р) + KOH (тв.) = KCl + NH3+ H2O;
Х + А ® ….. В
В – аммиак.
2NH4Cl (р-р) + H2O + SO3 (тв.)= (NH4)2SO4 + 2HCl;
Х + Б ® …… Г
Г – газ хлороводород.
В (NH3) и Г (HCl) реагируют с образованием Х (NH4Cl):
NH3 + HCl = NH4Cl.
Пример 8.
При кипячении водный раствор, содержащий соль NH4Cl, становится более кислым. Объясните наблюдаемое явление, напишите уравнения реакции.
Решение:
Хлорид аммония в водном растворе гидролизует по катиону:
NH4Cl + H2O ⇆ NH3⋅H2O + HCl
NH4+ + H2O ⇆ NH3⋅H2O + H+
В растворе среда кислая. Гидролиз – процесс, протекающий с поглощением тепла, поэтому, согласно принципу Ле Шателье, при нагревании равновесие смещается в сторону уменьшения температуры, то есть продуктов гидролиза, количество ионов водорода возрастает и среда становится более кислой.
Пример 9.
Имеется 2 л смеси оксида серы (IV) и кислорода. В результате реакции между ними образовалось 0,17 г оксида серы (VI). Определите объемный состав исходной смеси, учитывая, что оксид серы (IV) вступил в реакцию полностью. Укажите условия, необходимые для протекания реакции.
Дано:
V (смеси) = 2 л
m (SO3) = 0,17 г
М (SO3) = 80 г/моль
Найти:
j (SO2)
j (SO3)
Решение:
Для определения объемной доли оксида серы (IV) и кислорода в исходной смеси вычислим количество оксида серы (IV), вступившее в реакцию окисления.
Запишем уравнение реакции:
2SO2 + O2 = 2SO3.
По уравнению реакции соотношение n (SO2) : n (SO3) равно 1 : 1. Определим количество образовавшегося оксида серы (VI):
 (моль).
(моль).
Тогда количество вещества оксида серы (IV) равно 2,13 × 10-3 моль.
Объемная доля по определению равно:
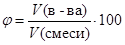 %.
%.
Объем смеси по условию равен 2 л. Вычислим объемы газов в смеси:
V (SO2) = n (SO2) × Vm = 2,13 × 10-3 × 22,4 = 0,048 (л).
V (O2) = V (смеси) - V (SO2) = 2 - 0,048 = 1,952 (л).
Тогда:
 (%);
(%);
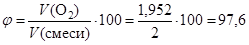 (%).
(%).
Реакция окисления оксида серы (IV) кислородом воздуха до оксида серы (VI) протекает при повышенной температуре (600–800 °C) в присутствии катализатора Fe2O3.
Ответ: j (SO2) = 2,4 %; j (O2) = 97,6 %.
|
из
5.00
|
Обсуждение в статье: Задачи для самостоятельного решения |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

