 |
Главная |
СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ
|
из
5.00
|
Количественной характеристикой раствора служит его концентрация, то есть количество растворенного вещества в определенном количестве раствора или растворителя. Различают массовую долю, молярную и нормальную концентрации. В аналитической химии наряду с общими химическими понятиями широко используют ряд таких понятий, которые присуще только ей и помогают характеризовать состав раствора. К ним относятся титр, эквивалент, титр по определяемому веществу. Рассмотрим каждый из способов определения концентрации вещества.
Массовая доля (ω) - отношение массы соответствующего компонента в растворе m(x) к общей массе этого раствора. Выражается в единицах или процентах.
ω (х)=  ; ω (х) %=
; ω (х) %=  ∙ 100%,
∙ 100%,
где m раствора = m растворенного вещества + m растворителя;
Согласно формуле ρ= m/V, где ρ- плотность раствора, m-масса, V- объем, тогда m раствора = Vраствора∙ ρ.
Численно массовая доля равна числу граммов вещества, растворенного в 100г раствора. Массовая доля всегда рассчитывается на безводное вещество. Масса растворенного вещества рассчитывается с точностью до третьего знака- 0,00Х.
Молярная концентрация (См) - отношение количества растворенного вещества к объему раствора.
Численно (См) равна количеству молей растворенного вещества, содержащегося в 1 л. раствора). Выражается она в моль/л. Сокращенно пишут М. Например, 2М (NaOH).
См=  ,
,
где 1моль/л = 1М раствор – одномолярный раствор (в 1 л раствора содержится 1 моль растворенного вещества);
0,1М – децимолярный раствор; 0,01М – сантимолярный раствор; 0,001М – милимолярный раствор.
Концентрация веществ в биологических жидкостях измеряется в миллимолях растворенного вещества содержащего в литре раствора (мМ/л). Так, содержание глюкозы в крови у здорового человека должно быть 5,8 мМ/л.
Молярная концентрация эквивалента (Нормальная концентрация СN или Н)- количество моль эквивалентов вещества, содержащегося в 1 л раствора
СN= 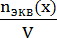 .
.
Единица измерения моль эквивалентов/л, Сокращенно обозначается буквой N. Если раствор 1Н раствор – в 1 л раствора содержится 1 эквивалент или 1 эквивалентная масса вещества; 0,1Н –О,1мольэквивалента растворенного вещества, раствор деценормальный.;
0,01М – сантинормальный раствор; Например, 0.1Н HCL означает, что в 1 литре такого раствора содержится 0,1моль эквивалент НСl. Если эквивалентная масса соляной кислоты равна 36,5г, то в 1 л 0,1Н раствора содержится 3,65г НС1. Эквивалентом вещества называется такое количество его, которое взаимодействует с одним моль атомов водорода или вообще с одним эквивалентом любого другого вещества. Обозначается эквивалент Э (Х), выражается в молях.
Масса одного эквивалента вещества называется эквивалентной массой, обозначается Мэкв, выражается в г/моль (экв). Эквивалент в большинстве случаев – величина переменная и зависит от типа реакции.
Если раствор 1Н раствор – в 1 л раствора содержится 1 эквивалент или 1 эквивалентная масса вещества; 0,1Н –О,1мольэквивалента растворенного вещества, раствор деценормальный.;
0,1М – децимолярный раствор; 0,01М – сантимолярный раствор;
0,001М – милимолярный раствор.
 Способы расчета Мэкв. Для кислот, оснований и солей: 1.
Способы расчета Мэкв. Для кислот, оснований и солей: 1. 
2.
3. 
Понятие эквивалентов в окислительно-восстановительных реакциях то же,
что в реакциях обмена. Однако способ расчета различен:
4. 
5. 
Закон эквивалентов предложен в 1814г. И.Рихтером: «Вещества взаимодействуют и получаются в массовых количествах прямо пропорционально их эквивалентам».
Математическое выражение этого закона:

m1, m2- массы веществ, Э1, Э2- эквиваленты веществ.
Пропорция не изменится, если поменять местами m2 с Э1. Тогда получим


 =
= 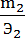
 =
=
Следствия закона:
1. 


 Объемы реагирующих растворов обратно пропорциональны их нормальным и молярным концентрациям:
Объемы реагирующих растворов обратно пропорциональны их нормальным и молярным концентрациям:
= ; для молярной концентрации = ;
или V1∙N1 = V2∙N2 , где V- объем реагирующих веществ, а N- нормальные концентрации реагирующих растворов. V∙N = 
2. При разбавлении растворов изменения объемов исходного и того же разбавленного раствора обратно пропорционально изменению их нормальным или молярным концентрациям:
V1∙N1 = V2∙N2 и V1∙М1 = V2∙М2 , где или V1∙N1 - количество вещества в растворе до разбавления, в исходном растворе; а V2∙N2 - после разбавлен.
Состав раствора можно характеризовать используя понятие моляльности.
Моляльностью {Cm(X)} раствора называется число молей растворённого вещества приходящееся на 1000 г растворителя.
Например, если растворить 1 моль сахарозы в 1000 г воды, то получается одномоляльный водный раствор сахарозы. Иначе говоря, моляльность – это отношение количества вещества растворённой порции частиц Х к массе порции растворителя:
Cm(X) = 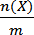 .
.
Единица измеренения в системе СИ моль/кг. Например
Cm(H2SO4/H2O) = 0,1 моль/кг.
Указанный способ выражения концентрации обычно используется при интерпретации влияния растворённого вещества на физические свойства единицы массы растворителя.
К таким свойствам относятся понижение давления пара, уменьшение температуры плавления и увеличение температуры кипения, а также осмотическое давление растворителя.
Эту концентрацию используют главным образом в физике и физико-химии.
Мольная доля – это отношение числа молей одного из компонентов раствора к полному числу молей всех компонентов раствора. Эту концентрацию используют при проведении экспериментальных работ как в химии, так и в физике.
Мольная доля, согласно названию, определяет ту часть полного количества молекул раствора, которая относится к растворённому веществу либо к растворителю. Если для двухкомпонентного раствора обозначить символом Na – число молей растворённого вещества, а символом Nb – число молей растворителя, то мольная доля растворённого вещества должна быть равна:
Ха =  ,
,
а мольная доля растворителя:
Хb =  .
.
Xa + Xb = 1. Для многокомпонентных систем должно выполняться аналогичное равенство, ∑Хi = 1. Указание концентрации растворов с помощью мольной доли применимо ко всем трём агрегатным состояниям. Мольная доля представляет собой безразмерную единицу измерения концентрации.
Титрованная концентрация (титр) (Т)- масса растворенного вещества,
содержащаяся в 1 мл раствора, выраженная в граммах. Определятся по формуле:
| = , |
Т
V
где m (в-ва) – масса вещества в г, V – объём раствора в мл.
Так как в 1л 1000мл, то зная титр можно рассчитать N раствора и по молярной концентрации эквивалента определить титр:
| = , |
Т
1000
где N – нормальная концентрация, МЭ (Х) – моль-эквивалент вещества (частиц) Х.
|
из
5.00
|
Обсуждение в статье: СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

