 |
Главная |
VI. Реакции по радикалу
|
из
5.00
|
1) Все циклические аминокислоты, содержищие бензольное кольцо
– триптофан, тирозин, фенилаланин – легко вступают в реакции замещения по бензольному кольцу с На12, НО–NO2, HO–SO3H.
Путем йодирования тирозина в организме образуется гормон щито- видной железы тироксин:
+ 2 I2
I
HO
2 HI
I
CH2 CH COOH NH2
Тирозин Дийодтирозин
I
>
| HO |
| CH2 CH COOH + HO NH2 |
I
Тироксин
Качественная реакция на ароматические аминокислоты – ксантопро- теиновая – обусловлена нитрованием бензольного кольца с образованием нитросоединений желтого цвета. При добавлении к ним щелочи возникает оранжевое окрашивание:
HO CH2 CH COOH + 2 HONO2 2 H O HO
CH2 CH COOH
NH2
2
O2N
NH2
2) Серусодержащие аминокислоты вступают в реакции окисления, солеобразования по меркапто –SH группе:
CH2 CH COOH
CH2 CH COOH
CH2
CH2
CH COOH
SH NH2
S NH2
S NH2
S CH3
NH2
Цистеин
СH2 СH
COOH
Метионин
Цистин
Цистеин и цистин легко превращаются друг в друга за счет реакции окисления – восстановления:


| 2H |
Цистеин
Цистин + Н2О
Обмен серы в организме идет, в основном, за счет цистина и цистеи- на. Они обусловливают структуру белка, реактивность многих ферментов и гормонов.
Качественной реакцией на серусодержащие аминокислоты является реакция Фоля:
CH2SH
t CH2 S Pb S CH2
2 CH NH2
+ Pb(CH3COO)2
CHNH2
H2NCH
+ 2 CH3COOH
COOH
COOH COOH
коричневый
БЕЛКИ
Белки – это биополимеры, состоящие из ста и более остатков амино- кислот.
Белки классифицируются на:
- 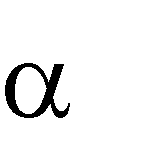 простые (протеины), состоящие из -аминокислот;
простые (протеины), состоящие из -аминокислот;
- сложные (протеиды), состоящие из белковой и небелковой частей.
Аминокислотный состав определяет многие свойства белков: заряд белковой молекулы, ИЭТ, способность к осаждению, структуру и биологи- ческую активность.
В настоящее время синтезированы простейшие белки – инсулин, ри- бонуклеаза, окситацин и др.
Первичная структура
Под первичной структурой подразумевают определенную последо- вательность фрагментов аминокислот в полипептидной цепи. Полипепти- ды содержат фрагменты до 22 разных аминокислот.
O H2N CH C
O
| OH + H |
COOH
2 H O
R R'
R'' 2
H2N CH R
C CH
| O C NH |
| O C NH |
COOH
Пептидная связь
Первичная структура белков строго специфична для каждого вида организмов. Так, гормон инсулин, построенный из 51 остатка одинаковых и различных α – аминокислот в виде двух цепей, соединенных дисульфид- ным мостиком, имеет неодинаковый состав у различных видов животных.
Вторичная структура
Отдельные молекулы белков взаимодействуют друг с другом, обра- зуя водородные связи, причем цепи “свертываются” в виде спиралей.
Особенности скручивания цепей белковых молекул (взаимное поло- жение фрагментов в пространстве) называется вторичной структурой белков.
“Скручивание” полипептидноых цепей в белковой молекуле в ци- линдрические спирали происходит строго закономерно, каждая спираль содержит нецелочисленное количество остатков (3, 7) аминокислот на один виток спирали. Такая спираль называется α – спиралью. Она может быть левой и правой. В глобулярных белках α – спираль не является един- ственным элементом структуры, так как для пептидных цепей таких бел- ков характерны “изгибы” и “повороты”, несовместимые с прямой спираль- ной структурой.
Третичная структура
Полипептидные цепи белков могут соединяться между собой с обра- зованием амидных, дисульфидных, гидрофобных, водородных и иных свя- зей за счет боковых цепей аминокислот. В результате возникновения этих связей происходит закручивание α – спирали в клубок. Эти особенности строения белков называют третичной структурой.
Четвертичная структура
Несколько отдельных полипептидных цепей способны укладываться в более сложные образования, называемые также комплексами или агрега- тами. При этом каждая цепь, сохраняя характерную для нее первичную, вторичную и третичную структуры, выступает в роли субъединицы ком- плекса с более высоким уровнем пространственной организацией – четвер- тичной структурой. Такой комплекс представляет собой единое целое и выполняет биологическую функцию, не свойственную отдельно взятым субъединицам. Четвертичная структура закрепляется за счет Н-связей и гидрофобных взаимодействий между субъединичными полипептидными цепями.
Определение четвертичной структуры белковых агрегатов возможно только с помощью высокоразрешающих физико - химических методов (рентгенография, электронная микроскопия). Четвертичная структура ха- рактерна лишь для некоторых белков, например, гемоглобина. Главная
функция гемоглобина (основного компонента эритроцитов) состоит в пе- реносе кислорода из легких к тканям организма. Его четвертичная струк- тура – образование из четырех полипептидных цепей (субъединиц), каждая из которых содержит гем.
Физико – химичекие свойства белков
Для белков характерны высокая вязкость растворов, низкая диффу- зия, способность к набуханию, подвижность в электрическом поле, низкое осмотическое давление.
Белки, как и аминокислоты, амфотерны за счет свободных амино - (–NН2) и карбоксильных ( –СООН) групп.
В зависимости от рН среды, соотношения кислых и оснóвных ами- нокислотных остатков белки несут положительный или отрицательный заряды, что и используется при электрофорезе.
Подобно биурету полипептиды и белки дают качественную реакцию с Сu(ОН)2 – красно-фиолетовое окрашивание и она называется биуретовой
реакцией.
Белки отличаются друг от друга по составу, форме, растворимости, биологической активности, молярной массе. Часть из них синтезируется в организме, другие должны поступать извне.
Строение белков было установлено на основе реакций гидролиза.
Фибриллярные белки – это белки, молекулы которых состоят из па- раллельных, сравнительно вытянутых пептидных цепей, образуют палоч- ковидные структуры. Они не растворимы и выполняют структурную и за- щитную функции в организме. Например, коллаген при нагревании пре- вращается в беспорядочные клубки, получившие название желатины (в ней много глицина, гидроксипролина, гидроксилизина).
Глобулярные белки – это белки, молекулы которых состоят из плотно свернутых полипептидных цепей и имеют форму, близкую к сферической. К ним относятся ферменты, антитела, гормоны, альбумин, гемоглобулин и другие. Они растворимы в водно - солевых растворах.
Некоторые белки, например, миозин и фибриноген имеют палочко- видную структуру, однако хорошо растворимы в воде.
Денатурация белков
Под влиянием многих факторов пространственная структура способ- на разрушаться, что приводит к потере биологической активности белков. К таким факторам относятся повышенная температура, изменение рН сре- ды, УФ – и рентгеновское излучения, механическое воздействие (встряхи- вание), соли тяжелых металлов, алкалоиды и др.
Денатурация белков – это разрушение их природной (нативной) про- странственной структуры с сохранением первичной структуры. Денатура- ция редко бывает обратимой. В этих немногих случаях важно то, что бес- порядочно скрученная молекула денатурированного белка самопроизволь- но принимает нативную пространственную структуру с полным сохране- нием биологической функции.
В случаях отравления солями тяжелых металлов (ртути, свинца, се- ребра и др.) в качестве противоядия используют белки с повышенным со- держанием кислотных групп, например яичный альбумин. Он действует как конкурент белков организма и сам связывает токсичный агент, образуя с ним нерастворимую соль, которая затем выводится из организма.
В организме содержится более 50.000 различных белков. Кожа со- держит 63% от массы сухой ткани, кости – 20%, зубы – 18%.
Функции белков:
1. Питательная (энергетическая – 20-25% – на белки), 17,6 кДж/г.
2. Транспортная (переносчики различных веществ) – гемоглобин, миогло- бин и др.
3. Сократительная (белки мышечных тканей) – миозин и др.
4. Структурная (пластическая) – коллаген, фиброин, мембранные белки.
5. Каталитическая (белки-ферменты) – пепсин, каталаза, уреаза и др.
6. Регуляторная (белки-гормоны) – инсулин, вазопрессин и др.
7.  Защитная (белки-антитела) – -глобулины сыворотки крови.
Защитная (белки-антитела) – -глобулины сыворотки крови.
8. Осмотическая, буферная, водно-солевая.
2.3. Лабораторная работа “Свойства аминокислот”
Опыт 1 Реакция глицина с нингидрином
В пробирку поместите 4 капли 1%-го р-ра глицина и 2 капли 0,1%-го р-ра нингидрина. Содержимое пробирки осторожно нагрейте. Что наблю- даете?
Напишите реакцию.
Опыт 2 Реакция глицина с азотистой кислотой
В пробирку поместите 5 капель 1%-го р-ра глицина и равный объем каплю 5%-го р-ра нитрита натрия. Добавьте 2 капли концентрированной уксусной кислоты и осторожно взболтайте смесь. Наблюдайте выделения газа.
Эта реакция используется для количественного определения аминог- рупп в аминокислотах.
Напишите схему взаимодействия глицина с азотистой кислотой. На- зовите образовавшиеся соединения.
Опыт 3 Образование комплексной соли меди глицина
В пробирку поместите 1 мл 1%-го р-ра глицина. Добавьте на кончике лопаточки кристаллический карбонат меди (II) и смесь нагрейте. Что на- блюдаете?
Напишите схему взаимодействия глицина с карбонатом меди (II).
Опыт 4 Биуретовая реакция на пептидную связь
В пробирку поместите 5 капель р-ра яичного белка, добавьте равный объем 10%-го р-ра гидроксида натрия и по стенке добавьте 2 капли р-ра сульфата меди (II). Что наблюдаете?
Напишите схему образования биурета. Все ли белки дают биурето- вую реакцию?
Опыт 4 Ксантопротеиновая реакция белков
В пробирку поместите 10 капель р-ра яичного белка и 2 капли концентрированной азотной кислоты. Содержимое пробирки осторожно нагрейте, постоянно встряхивая. Что наблюдаете? Охладив пробирку, ос- торожно добавьте 3 капли 10%-го р-ра гидроксида натрия до появления ярко – оранжевой окраски.
Какие α – аминокислоты в составе белка можно открыть с помощью касантопротеиновой реакции.
Опыт 5 Реакция на присутствие серусодержащих α – аминокислоты (реакция Фола)
В пробирку поместите 10 капель р-ра яичного белка и 20 капель 10%-го р-ра гидроксида натрия. Содержимое пробирки перемешайте и на- грейте до кипения. К полученному щелочному р-ру добавьте 5 капель 10%-го р-ра ацетата свинца (CH3COO)2Pb и вновь прокипятите. Что на- блюдаете?
Напишите в общем виде схему реакции белка с ацетатом свинца (II). Какие α – аминокислоты в составе белка можно открыть с помощью реак- ции Фола.
|
из
5.00
|
Обсуждение в статье: VI. Реакции по радикалу |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

