 |
Главная |
ТИТРИМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
|
из
5.00
|
Методы аналитической химии широко реализуются в фармацевтической промышленности при получении и контроле лекарственных препаратов, в санитарно-гигиенической практике для анализа объектов окружающей среды. Необходимо так же постоянно анализировать продукты пищевого производства, особенно на присутствие ядохимикатов, тяжелых металлов, канцерогенных веществ.
Огромное значение имеет химический анализ для наук биологического цикла. Например, выяснение природы белка - задача, в сущности, аналитическая, поскольку требуется выяснить, какие аминокислоты входят в состав белка и в какой последовательности они связаны. В медицине методы аналитической химии широко применяют для определения кислотности желудочного сока, содержание мочевой кислоты, аммиака в моче, сахара в крови и т.д.
Измерение количества (концентрации или массы) составных частей анализируемого объекта или их количественных соотношений- изучает соответствующий раздел аналитической химии - количественный анализ.
В основе количественного анализа лежит точное измерение величины интенсивности аналитического сигнала, исходящего от объекта при определенном воздействии на него. В простейшем случае аналитическим сигналом может быть интенсивность окраски, изменение рН раствора.
Задачей современной аналитической химии является разработка новых, более чувствительных, точных, быстрых и специфичных метода анализа.
А так же совершенствование существующих методов. конструирование новых приборов, синтез новых реактивов, автоматизация и компьютеризация методов анализа.
Очень важно для количественного анализа понятие «точность», она имеет собирательный характер и характеризует суммарную погрешность определения, включающую случайную погрешность (воспроизводимость) и
систематическую (правильность).
Результаты анализа называются точными, если они хорошо воспроизводимы и не имеют существенной систематической погрешности.
Сравнение возможностей различных методов анализа показывает, что точность аналитических определений является одним из самых мало изменившихся за последние 50 лет параметров. Так, наименьшую относительную погрешность на уровне 0,001% имеет кулонометрический анализ, далее в этом ряду стоит гравиметрия (0,01%), титриметрия (0,1%), а затем все физические методы, погрешность определений в которых может доходить до нескольких процентов. Уменьшения случайной погрешности, обусловленной сходимостью результата определения, добиваются обычно применением компьютеров, позволяющих измерять сигнал сотни и тысячи раз и затем проводить его статистическую обработку.
Одним из наиболее распространенных и доступных методов аналитической химии является титриметрический, предложенный в 1880 году Гей-Люссаком.
Титрование – процесс непрерывного добавления одного раствора (точно известной концентрации небольшими порциями (каплями) к другому
(концентрацию которого необходимо установить) до достижения точки эквивалентности (т.э.). Момент, при котором к титруемому компоненту добавлено эквивалентное количество титранта (раствора с известной концентрацией вещества), отвечающий стехиометрическому уравнению взаимодействия, называется точкой эквивалентности.
В точке эквивалентности количества реагирующих веществ равны:
n Э1 = n Э2
Титриметрические методы анализа служат для определения основных компонентов и примесей. Титрование применяют в анализе органических и неорганических соединений, а так же биологических жидкостей. В основе титриметрического метода лежит химическая реакция.
В процессе титрования обычно добавляют вещество, количество которого можно точно измерить, т.е. концентрация которого точно известна. Такой раствор называется стандартным раствором.
При титровании после добавления каждой порции титранта изменяются равновесные концентрации всех компонентов реакции.
Концентрация определяемого вещества уменьшается, а продуктов реакции увеличивается.
За этими изменениями наблюдают.
В конце титрования измеряют количество добавленного вещества. Обычно измеряют объем или другую характеристику (масса, электропроводность, потенциал, оптическую плотность).
Зная количество добавленного компонента, рассчитывают количество определяемого вещества по закону эквивалентов.
Математическое выражение этого закона:
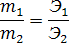
Следствие закона: Объемы реагирующих растворов обратно пропорциональны их нормальным и молярным концентрациям:
V1N1= V2N2
Основная формула для расчета в титриметрическом анализе.
Таким образом, независимо от типа реакций, используемых в титровании, необходимо знание точных объемов растворов реагирующих веществ и точно известной концентрации одного из них.
|
из
5.00
|
Обсуждение в статье: ТИТРИМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

