 |
Главная |
Двухосновные карбоновые кислоты.
|
из
5.00
|
Для двухосновных кислот характерны те же реакции, но с образовани- ем моно- и дипроизводных – кислых и средних солей, неполных и полных эфи- ров, ангидридов, амидов:
COOH
COONa
+NaOH
COONa
COOH + NaOH
Щавелевая кислота
-H2O
COOH -H2O
Гидро- оксалат натрия
H2SO4 , t
COONa
Оксалат натрия
O
HOOC-CH2-COOH
+ C2H5OH
C2H5O C CH2COOH
-H2O
Моноэтиловый эфир маноловой к-ты, моноэтилмонолат
O
C2H5O C
CH2COOH
O
| -H O |
2
O
CH2 C
C2H5
Диэтиловый эфир малоновой к-ты, диэтилмалонат
Из особых (специфических) свойств дикарбоновых кислот следует отме- тить их поведение при нагревании.
Результат нагревания дикарбоновых кислот зависит от расположения карбоксильных групп в цепи.
Если карбоксильные группы расположены близко друг к другу, то проис- ходит декарбоксилирование, то есть удаление карбоксильной группы путем отщепления углекислого газа. Это характерно для щавелевой и малоновой ки- слот.
t
HOOC-COOH HCOOH
-CO2
щавелевая кислота
муравьиная кислота
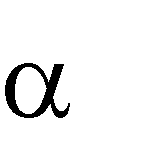 Направление реакции объясняется сильным акцепторным действием вто- рой карбоксильной группы на соседню. Одноосновные кислоты устойчивы к нагреванию, однако в случае нахождения у -углеродного атома сильной ак- цепторной группы при 100 – 150 оС ведут себя аналогично (идет декарбокси- лирование):
Направление реакции объясняется сильным акцепторным действием вто- рой карбоксильной группы на соседню. Одноосновные кислоты устойчивы к нагреванию, однако в случае нахождения у -углеродного атома сильной ак- цепторной группы при 100 – 150 оС ведут себя аналогично (идет декарбокси- лирование):
t
HOOC-CCl3
CHCl3
+ CO2
трихлоруксусная кислота
хлороформ
Если карбоксильные группы удалены друг от друга, то при нагревании образуются внутренние ангидриды:
CH2 CH2
COOH t COOH -H2O
O
CH2 C O CH2 C
O
Янтарная к-та
Аналогично образуются ангидриды малеиновой и фталевой кислот:
O CH COOH t CH O
CH COOH -H2O CH
O
COOH t C
O
COOH -H2O C
Малеиновая к-та
O O
Фталевая к-та
Терефталевая (п-дикарбоксибензол) и фумаровая (транс- бутендионовая) кислоты такого ангидрида не образуют из-за пространствен- ных факторов.
Мочевина
Впервые была выделена из мочи, является конечным продуктом распада белков у животных. Взрослый человек в сутки выделяет с мочой 25 – 30 г мо- чевины. Мочевина является производным угольной кислоты.
В промышленности мочевину получают:
2NH3 + CO2
t, p
-H2O
H2N
C NH2 O
Большая часть ее используется в качестве азотного удобрения. Значи- тельное количество ее расходуется на получение мочевиноформальдегидных смол, имеющих большую роль в технике.
Физические свойства
Мочевина – бесцветное кристаллическое вещество (т. пл. 133 оС), хорошо растворима в воде, обладает оснóвными свойствами.
Химические свойства
В химическом отношении мочевина проявляет свойства аминов и амидов кислот.
Основные свойства
 Как амины она образует соли с минеральными и сильными органически- ми кислотами. Являясь слабым основанием (р, -сопряжение ослабляет оснóвные свойства), она реагирует только с одним эквивалентом кислоты.. Ре- акция образования нитрата мочевины используется в клинике для выделения мочевины из мочи.
Как амины она образует соли с минеральными и сильными органически- ми кислотами. Являясь слабым основанием (р, -сопряжение ослабляет оснóвные свойства), она реагирует только с одним эквивалентом кислоты.. Ре- акция образования нитрата мочевины используется в клинике для выделения мочевины из мочи.
Оснóвным центром в мочевине считают атом кислорода. Соли нитрат и оксалат мочевины – твердые вещества, плохо растворимы в воде:
H2N
C NH2
+ HNO3
[H2N
C NH2
-
] NO3
O
Мочевина

 + COOH COOH
+ COOH COOH
[H2N
+ OH
C
+ OH
NH2
Нитрат мочевины
-
] COO
COOH
Щавелевая к-та
Оксалат мочевины
2. Взаимодействие с азотистой кислотой (НNO2).
При действии азотистой кислоты мочевина, как первичный амин, выделя- ет азот. Это находит применение для количественного определения мочевины по объему выделившегося азота:


 (NH2)2CO + 2HONO 2N2 + CO2 + 3H2O
(NH2)2CO + 2HONO 2N2 + CO2 + 3H2O
Реакции алкилирования
 При действии алкилирующих средств получают алкилмочевину: Н2N– C –NH2 + С1 – СН3 Н2N– C –NH–СН3 + НС1
При действии алкилирующих средств получают алкилмочевину: Н2N– C –NH2 + С1 – СН3 Н2N– C –NH–СН3 + НС1
|| ||
O O
Метилмочевина
Образование уреидов
При действии ацилирующих средств (RCO-C1) получают уреиды. Неко- торые из них являются лекарственными препаратами.
Н2N–CO–
t


| HC1 |
| Ацетилхлорид ||
H O
ацетилмочевина
СН3– CH – CH – C –NHСОNH2
| | ||
CH 3 Br O
Бромизовал (бромурал) – снотворное средство.
Важное значение имеет уреид мочевины и малоновой кислоты:
NH2
Cl C O t
O
NH C
O C +
NH2 Cl
CH2
C O
-2HCl
O C CH2 NH C
Мочевина
Хлорангидрид малоновой к-ты
O
Малонилмочевина,
барбитуровая кислота
Производные барбитуровой кислоты обладают снотворным действием:
| O C2H5 HN C C C H 2 5 (C6H5) C C O NH O | Диэтилбарбитуровая кислота – веро- нал, Этилфенилбарбитуровая кислота – люминал. |
5. Гидролиз мочевины
Мочевина гидролизуется в присутствии кислот или щелочей. В организме гидролиз проходит под действием фермента уреазы:
 (NH2)2CO + HOH CO2 + 2NH3
(NH2)2CO + HOH CO2 + 2NH3
| + |
H2N
CO N
CO NH2
t
| H2N |
| H |
H2N-CO-NH-CO-NH2
H 3 Биурет
Биурет с гидроксидом меди (II) в щелочной среде образует комплексное соединение красно-фиолетового цвета. Эта качественная реакция называется биуретовой, она служит для обнаружения пептидов и белков.
H2N
C O
H2N
C
 NH2
NH2
H2N
C O
NH2
 O C
O C
NH
+ Cu(OH)2 +
NH
N Cu N
C O
H2N
C O
H2N
-2H2O
C O
H2N
O C
NH2
6. Действие щелочного раствора гипобромита натрия.

 Происходит выделение азота и образование угольной кислоты: (NH2)2CO + 3NaBrO 3NaBr + N2 + CO2 + 2H2O
Происходит выделение азота и образование угольной кислоты: (NH2)2CO + 3NaBrO 3NaBr + N2 + CO2 + 2H2O
|
из
5.00
|
Обсуждение в статье: Двухосновные карбоновые кислоты. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

