 |
Главная |
Основы геометрической оптики. 7 страница
|
из
5.00
|

Раскрыв скобки, получим:

Разделим все на  :
:

Перегруппируем слагаемые, учитывая, что  :
:

Таким образом, мы получили выражение для расчета частоты 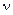 рассеянного фотона. Обычно это выражение переписывают через длины волн падающего фотона
рассеянного фотона. Обычно это выражение переписывают через длины волн падающего фотона  и рассеянного фотона
и рассеянного фотона  :
:
 (3.8)
(3.8)
Т.е. длина волны рассеянного излучения больше длины волны падающего излучения. Эту формулу обычно представляют в виде:

Здесь 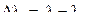 ‑ изменение длины волны падающего фотона,
‑ изменение длины волны падающего фотона,  ‑ комптоновская длина волны:
‑ комптоновская длина волны:
 (3.9)
(3.9)
Относительное изменение длины волны рассеянного фотона будет рассчитываться как:

В случае прямого отражения  , эта формула примет вид:
, эта формула примет вид:

Для рентгеновских лучей, у которых  , относительное изменение длины волны рассеянного фотона составит:
, относительное изменение длины волны рассеянного фотона составит:

Для видимого света  , относительное изменение длины волны рассеянного света составит:
, относительное изменение длины волны рассеянного света составит:

Т.е. пренебрежимо мало. Тем более для радиоволн.
Лекция 9 (2 часа)
Электронная оболочка атома и теория Бора.
(Классическая модель атома и ее недостатки. Опыты Резерфорда по рассеянию a-частиц. Постулаты Бора. Опыты Франка и Герца. Элементарная Боровская теория атома водорода. )
Закономерности линейчатых спектров водорода
Как уже отмечалось, линейчатые спектры излучения дают отдельные, изолированные атомы. Поэтому изучение линейчатых спектров явилось ключом к пониманию строения атома ‑ этого неделимого кирпичика материи.
При исследовании спектров, было установлено, что линии спектров испускания расположены не хаотично, а образуют определенную закономерность. Все линии имеют тенденцию группироваться, образуя так называемые серии.
     |
Наиболее простым закономерностям подчиняется спектр атома водорода. На рис. 3.1. показаны спектральные линии в видимой области спектра для водорода.
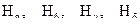 ‑ видимые линии серии,
‑ видимые линии серии,  ‑ граница серии.
‑ граница серии.
Швейцарский физик Бальмер (1885 г.) показал, что длины волн этой серии могут быть представлены в виде формулы:

Если от длин волн перейти к частотам, то получится следующая формула:
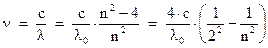
Обычно эту формулу переписывают в виде:
 (3.1)
(3.1)
В таком виде формула (3.1) называется формулой Бальмера. Постоянная  , в формуле Бальмера, называется постоянной Ридберга. Ее численное значение найдено экспериментально
, в формуле Бальмера, называется постоянной Ридберга. Ее численное значение найдено экспериментально  .
.
Формула Бальмера дает закономерность распределения линий в серии, поэтому иногда ее называют серией Бальмера.
Дальнейшие исследования показали, что в спектре водорода имеются еще серии, которые названы по фамилиям их исследовавших ученых и эти серии описываются аналогичными формулами.
Серия Лаймана 
Серия Бальмера 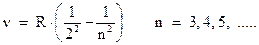
Серия Пашена 
Серия Брекета 
Серия Пфунда 
Все эти серии можно объединить ой общей формулой:
 (3.2)
(3.2)
При возрастании 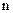 частота каждой серии стремится к предельному значению
частота каждой серии стремится к предельному значению

которая называется границей серии. По аналогии, начало серии будет определяться как

Выражение  называется спектральным термом или просто термом и обозначается
называется спектральным термом или просто термом и обозначается  . В этом случае обобщенная формула Бальмера примет вид:
. В этом случае обобщенная формула Бальмера примет вид:
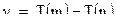
Для более сложных атомов частоты также можно представить в виде разности термов, но термы имеют более сложное строение и могут быть вообще из разных серий.
Модель атома Томсона
Изучение спектров изолированных атомов показало, что атомы имеют какое-то внутреннее строение, что это не есть неделимые кирпичики материи. Надо было объяснить наблюдаемые спектры, т.е. надо было объяснить строение атома.
 К тому времени были уже известны отрицательно заряженные частицы ‑ электроны и положительно заряженные частицы ‑ протоны. Причем, масса протона во много раз больше массы электрона, а заряд равен заряду электрона.
К тому времени были уже известны отрицательно заряженные частицы ‑ электроны и положительно заряженные частицы ‑ протоны. Причем, масса протона во много раз больше массы электрона, а заряд равен заряду электрона.
Исходя из этого, Томсон в 1903 году предложил следующую модель строения атома. Атом представляет собой положительно заряженную сферу, внутри которой находится электрон (см. рис. 3.2).
Напряженность электрического поля внутри заряженной сферы определяется выражением (II.1.11):

так как заряд положительной сферы равен заряду протона, т.е. заряду электрона.
Тогда на электрон, находящийся внутри заряженной сферы, со стороны электрического поля действует сила, направленная к центру сферы:

где  . Отсюда следует, что на электрон в атоме действует квазиупругая сила, подобная силе механической пружины, коэффициент жесткости которой равен
. Отсюда следует, что на электрон в атоме действует квазиупругая сила, подобная силе механической пружины, коэффициент жесткости которой равен  .
.
Т.е. если электрон вывести из положения равновесия (центр атома), то он начнет совершать колебания, с частотой, равной (I.2.6)

При гармонических колебаниях электрон будет двигаться ускоренно и, следовательно, должен излучать электромагнитные волны. Частота этих электромагнитных волн совпадает с частотой колебаний электрона. Зная частоту, можно определить радиус атома. Действительно, из формулы для собственной частоты колебаний электрона в атоме получим:

Подставим числовые значения:

Произведя вычисления, получим:
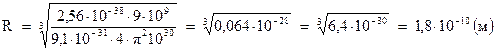
Полученное числовое значение радиуса атома совпадает со значением, полученным из газокинетических представлений.
Опыты Резерфорда
Но модель атома Томсона ‑ это гипотеза. Для ее подтверждения или опровержения нужны были прямые опыты. Т.е. нужно было поставить эксперименты по прямому зондированию атомов. Для этого нужно было направлять на атом потоки частиц высоких энергий и изучать их рассеяние.
Такие опыты были поставлены Резерфордом. В его распоряжении были естественные радиоактивные вещества, которые излучали частицы высоких энергий, в частности  - частицы.
- частицы.

 - частицы ‑ это двукратно ионизированный атом гелия, т.е. атом гелия, у которого выбито два электрона. Соответственно,
- частицы ‑ это двукратно ионизированный атом гелия, т.е. атом гелия, у которого выбито два электрона. Соответственно,  - частица имеет заряд, равный двум положительным зарядам электрона.
- частица имеет заряд, равный двум положительным зарядам электрона.
Резерфорд с помощью свинцового экрана  (см. рис. 3.3) получал узкий пучок
(см. рис. 3.3) получал узкий пучок  - частиц, помещенных внутрь экрана, а затем этот пучок
- частиц, помещенных внутрь экрана, а затем этот пучок  - частиц направлял на очень тонкую фольгу металла. На атомах фольги происходило рассеяние
- частиц направлял на очень тонкую фольгу металла. На атомах фольги происходило рассеяние  - частиц. Вокруг фольги располагался экран
- частиц. Вокруг фольги располагался экран  из сернистого цинка. При попадании
из сернистого цинка. При попадании  - частицы на этот экран она давала вспышку света ‑ сцинциляцию (поэтому такие экраны называются сцинциляционными экранами), которая регистрировалась с помощью зрительной трубы
- частицы на этот экран она давала вспышку света ‑ сцинциляцию (поэтому такие экраны называются сцинциляционными экранами), которая регистрировалась с помощью зрительной трубы  .
.
Положение экрана и зрительной трубы могло быть установлено под любым углом к направлению распространения луча  - частиц. Тем самым можно было подсчитать число
- частиц. Тем самым можно было подсчитать число  - частиц, распространяющихся под разными углами. Скорость
- частиц, распространяющихся под разными углами. Скорость  - частиц имеет величину порядка
- частиц имеет величину порядка  .
.
Первые же эксперименты дали совершенно неожиданные результаты. Дело в том, что наблюдались  - частицы под углом
- частицы под углом 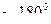 . Почему же это неожиданно? Дело в том, что если
. Почему же это неожиданно? Дело в том, что если  - частица отклоняется назад, то схема ее взаимодействия с атомом фольги должна быть такова.
- частица отклоняется назад, то схема ее взаимодействия с атомом фольги должна быть такова.
 - частица приближается прямо к атому по осевой линии. Вследствие кулоновского отталкивания она тормозится. В некоторый момент она останавливается, при этом вся ее кинетическая энергия переходит в потенциальную энергию, а затем начинает двигаться назад.
- частица приближается прямо к атому по осевой линии. Вследствие кулоновского отталкивания она тормозится. В некоторый момент она останавливается, при этом вся ее кинетическая энергия переходит в потенциальную энергию, а затем начинает двигаться назад.
Найдем наименьшее расстояние, на которое  - частица сблизится с атомом. Согласно закону сохранения энергии, можно записать:
- частица сблизится с атомом. Согласно закону сохранения энергии, можно записать:

Отсюда получим выражение для минимального сближения:

Учитывая, что масса  - частицы равна
- частицы равна  , для
, для  получим:
получим:

Но, как известно, радиус атома составляет величину, порядка  . Таким образом, получается что
. Таким образом, получается что  - частица проникает внутрь атома. Но тогда кулоновское взаимодействие нужно считать по другой формуле. А именно, учесть, что напряженность поля внутри атома Томсона определяется выражением
- частица проникает внутрь атома. Но тогда кулоновское взаимодействие нужно считать по другой формуле. А именно, учесть, что напряженность поля внутри атома Томсона определяется выражением  . Этот учет приводит к тому, что
. Этот учет приводит к тому, что  - частица не может быть отброшена назад атомом при существующих значениях скоростей
- частица не может быть отброшена назад атомом при существующих значениях скоростей  .
.
Т.е. эти эксперименты наносят удар по модели атома Томсона.
Планетарная модель атома Резерфорда
Исходя из рассмотренных результатов опыта, Резерфорд пришел к выводу, что модель атома Томсона не верна.
Резерфорд предложил свою, ажурную модель атома, согласно которой атом представляет собой систему, подобную солнечной системе.
В центре находится положительно заряженное ядро, заряд которого равен 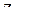 , а вокруг него вращаются
, а вокруг него вращаются  электронов по орбитам. При этом вся масса атома практически сосредоточена в его ядре.
электронов по орбитам. При этом вся масса атома практически сосредоточена в его ядре.
Электрон должен вращаться вокруг ядра, чтобы система была устойчивой. Ядро имеет размеры, не превосходящие  , а размеры атома имеют те же величины
, а размеры атома имеют те же величины  .
.
При попадании  - частиц в фольгу, взаимодействием с ее электронами можно пренебречь, поскольку электроны имеют массу, гораздо меньшую массы
- частиц в фольгу, взаимодействием с ее электронами можно пренебречь, поскольку электроны имеют массу, гораздо меньшую массы  - частиц.
- частиц.
Действительно, при взаимодействии  - частицы с электронами должны бы измениться как скорость
- частицы с электронами должны бы измениться как скорость  - частицы, так и скорость электрона. Посмотрим, так ли это.
- частицы, так и скорость электрона. Посмотрим, так ли это.
На основании закона сохранения импульса запишем:

Отсюда

Соответственно, скорость  - частицы после взаимодействия будет равна:
- частицы после взаимодействия будет равна:

Предположим самый неблагоприятный случай  . При этом
. При этом

Пусть  , т.е. такая же, как и у
, т.е. такая же, как и у  - частицы ‑
- частицы ‑  . Тогда
. Тогда

Но так как  , то
, то 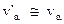 . Т.е. скорость
. Т.е. скорость  - частицы практически не меняется.
- частицы практически не меняется.
Итак,  - частица взаимодействует только с ядром атома.
- частица взаимодействует только с ядром атома.
Исходя из предложенной им модели атома, Резерфорд рассчитал относительное количество  - частиц, рассеянных под тем или иным углом
- частиц, рассеянных под тем или иным углом  от первоначального направления. При этом он получил формулу, которая называется формулой Резерфорда:
от первоначального направления. При этом он получил формулу, которая называется формулой Резерфорда:

где  ‑ относительное число частиц внутри телесного угла
‑ относительное число частиц внутри телесного угла  ; заключенного в промежутке от
; заключенного в промежутке от  до
до  ;
;  ‑ толщина фольги;
‑ толщина фольги; 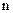 ‑ число атомов в единице объема;
‑ число атомов в единице объема; 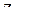 ‑ заряд ядра;
‑ заряд ядра; 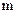 ‑ масса
‑ масса  - частицы;
- частицы; 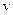 ‑ скорость
‑ скорость  - частицы.
- частицы.
Эксперименты показали полное совпадение результатов опыта с теоретической формулой.
Казалось бы, результаты опыта подтверждают планетарное строение атома, но здесь возникает другое «но».
Электрон, вращаясь вокруг ядра по круговой орбите, обладает центростремительным ускорением. А если он обладает ускорением, то согласно законам классической электродинамики он должен излучать электромагнитные волны, т.е. терять энергии. А если он будет терять энергию, радиус его орбиты будет уменьшаться и он, в конце концов, упадет на ядро. В действительности же атом, как известно, представляет собой чрезвычайно устойчивую систему.
Постулаты Бора
Итак, модель атома Резерфорда не объясняет устойчивость атома и не объясняет спектр атомов. Однако она подтверждается другими экспериментальными фактами и поэтому ее просто так отбросить нельзя.
Выход из создавшегося тупика был предложен датским физиком Нильсом Бором в 1913 году.
Свои предложения Нильс Бор сформулировал в виде двух постулатов.
1). В атоме существуют так называемые разрешенные орбиты, по которым электрон, двигается хотя и с ускорением, но не излучает электромагнитную энергию. Эти орбиты подчиняются определенным квантовым условиям.
2). Излучение испускается или поглощается атомом лишь при переходе с одной стационарной (разрешенной) орбиты на другую. При этом величина энергии светового кванта равна разности энергий этих стационарных состояний, между которыми совершается квантовый скачок электрона:
 (3.3)
(3.3)
Соответственно частота излучения будет равна:

Если принять, что энергия электрона, удаленного на бесконечно большое расстояние от ядра равна нулю, тогда энергия электрона в атоме будет отрицательна (при удалении электрона необходимо совершать положительную работу, сообщая тем самым электрону положительную энергию). Следовательно, выражение для частоты можно переписать как:

Эта формула согласуется со спектроскопическими данными, рассмотренными выше, согласно которым частота линии равна разности термов:

Применение теории Бора к водородоподобным атомам
Для объяснения спектра атомарного водорода Бор, основываясь на своих постулатах, сделал предположение, что в атоме водорода стационарными, разрешенными, устойчивыми орбитами являются только те орбиты, для которых момент импульса равен целому кратному постоянной Планка, деленной на  . Т.е.
. Т.е.
 (3.4)
(3.4)
где  - число, называемое главным квантовым числом.
- число, называемое главным квантовым числом.
Исходя из этих представлений, вычислим радиусы стационарных орбит.
Вращаясь вокруг ядра, электрон испытывает центробежное ускорение  . Поскольку электрон находится на устойчивой орбите, то центробежная сила должна равняться кулоновской силе притяжения к ядру:
. Поскольку электрон находится на устойчивой орбите, то центробежная сила должна равняться кулоновской силе притяжения к ядру:
 (3.5)
(3.5)
Но согласно (3.4), 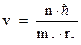 . Следовательно:
. Следовательно:

Для первой водородной орбиты и  получим:
получим:

т.е. порядка тех же газокинетических размеров. Таким образом, радиус разрешенных орбит определяется выражением:
 (3.6)
(3.6)
Энергия электрона в атоме слагается из его потенциальной энергии в электрическом поле ядра:

и кинетической энергии его движения по орбите со скоростью 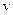 :
:

Таким образом, полная энергия электрона  будет равна:
будет равна:

Но согласно (3.5) ‑  . Отсюда вытекает, что
. Отсюда вытекает, что

Таким образом, выражение для полной энергии примет вид:

 Подставляя в это выражение значение радиуса (3.6), получим:
Подставляя в это выражение значение радиуса (3.6), получим:

Таким образом, схема энергетических уровней атома водорода будет иметь вид, изображенный на рис. 3.4.
При переходе электрона из одного энергического состояния в другое испускается квант электромагнитной волны с энергией:

Следовательно, частота излучаемого света будет равна:

Сравнивая полученное выражение с формулой Бальмера (3.2), получим, что постоянная Ридберга должна определяться выражением:

Таким образом, получено теоретическое выражение для константы Ридберга. Подставим сюда значения универсальных констант:

Полученное теоретическое значение очень хорошо согласуется с экспериментальным значением, найденным из спектроскопических данных.
Итак, теория атома Бора в применении к атому водорода дала поразительно точные результаты.
Теория Бора показала, что к внутриатомным процессам нельзя применять понятия классической физики.
Опыты Франка и Герца

 Итак, постулаты Бора требуют, чтобы уровни энергий внутри атома
Итак, постулаты Бора требуют, чтобы уровни энергий внутри атома
|
из
5.00
|
Обсуждение в статье: Основы геометрической оптики. 7 страница |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

