 |
Главная |
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ. ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В МОЛЕКУЛАХ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.
|
из
5.00
|
Цель занятия: формирование у студентов представлений о типах органиче- ских реакций, электронном строении органических соединений, взаимном влиянии атомов и способах их передачи (электронных эффектах).
Студент должен знать:
- типы органических реакций;
- теорию электронного строения органических соединений;
- способы передачи взаимного влияния атомов в молекулах органических соеди- нений.
Студент должен уметь
- определять типы органических реакций;
- объяснять влияние заместителей на распределение электронной плотность в молекуле органического соединения, их влияние на реакционный центр;
- на основании взаимного влияния функциональных групп в молекулах биологиче- ски важных веществ сравнивать и предсказывать их реакционную способность.
3.1. Классификация органических реакций
Химические реакции – это процессы, в результате которых из одних ве- ществ образуются другие, отличающиеся от исходных по составу и (или) строению. В ходе реакции в молекулах реагирующих веществ разрываются одни химические связи и образуются другие.
Участвующее в реакции органическое вещество называют субстратом.
Взаимодействующее с субстратом вещество называют реагентом.
Классифицировать реакции можно по различным признакам. В соответ- ствии с природой реагента, органические реакции делятся на следующие ти- пы:
1. Гомолитические или радикальные реакции.
Гомолитические или радикальные реакции сопровождаются гомолитиче- ским разрывом ковалентных связей. При гомолитическом разрыве общая элек- тронная пара распадается таким образом, что каждому атому достается по одно- му электрону:

| А B |
При гомолитическом разрыве связи образуются свободные радикалы. Свобод- ный радикал – это атом или группа атомов, имеющая неспаренный электрон. Свободный электрон радикала обозначается точкой (Н∙, Cl∙, СН3∙ и т. д.). Радика- лы чрезвычайно химически активны и имеют очень малое время жизни.
2. Гетеролитические или ионные реакции.
Гетеролитические или ионные реакции сопровождаются гетеролитическим разрывом ковалентной связи. Гетеролитический разрыв происходит таким обра- зом, что общая электронная пара остается у одного из атомов. Этот атом приоб- ретает отрицательный заряд, а атом, оставшийся без электронов – положитель- ный:
А B A+
+ B-
Таким образом, результатом гетеролитического разрыва связи является образо- вание ионов. В зависимости от того, какой из ионов взаимодействует с субстра- том, гетеролитические реакции делятся на электрофильные и нуклеофильные. Электрофил (в переводе с греческого – «любящий электроны») – это час- тицы, обладающие дефицитом электронной плотности. Чаще всего электрофилы имеют положительный заряд (Н+, NO2+), но могут быть и нейтральными молеку-
лами (SO3). Электрофил взаимодействует с реакционным центром субстрата, имеющим избыток электронной плотности.
Нуклеофил (в переводе с греческого – «любящий ядро») – это частица, обладающая избытком электронной плотности. Нуклеофилы могут иметь отри- цательный заряд (ОН−, Cl−) или не иметь заряда (NH3, H2O). Нуклеофил взаимо- действует с реакционным центром субстрата, имеющим недостаток электронной плотности.
Широко распространена классификация органических реакций по конеч- ному результату. По этому признаку реакции делятся на следующие виды:
1. Реакции замещения
Это реакции, в которых атом или группа атомов, входящих в состав суб- страта, замещается атомом или группой атомов, входящих в состав реагента. Обозначается буквой S (от английского слова substitution – замещение). В зави- симости от природы реагента различают:
Реакции радикального замещения (SR):
CH4
hυ
+ Cl2
CH3Cl +
HCl
Реакции электрофильного замещения (SЕ):
NO2
+ HNO3
H2SO4
+ H2O
Реакции нуклеофильного замещения (SN):
CH3 Cl + NaOH CH3 OH + NaCl
2. Реакции присоединения
Это реакции, в которых молекулы субстрата и реагента соединяются в од- ну новую молекулу (продукт). Обозначается буквой Аd или A (от английского слова addition – присоединение). В зависимости от природы реагента различают:
Реакции радикального присоединения (АdR):
CH2 CH2 + H2
t0, p Ni
CH3 CH3
Реакции электрофильного присоединения (АdЕ):
CH2 CH2 +
Br2
CH2 CH2
Br Br
Реакции нуклеофильного присоединения (АdN):
O OH
CH3 C + H
HCN CH3 C CN H
3. Реакции отщепления или элиминирования
Это реакции, в которых происходит отрыв атома или группы атомов от молекулы субстрата. Обозначается буквой Е (от английского слова elimination – отщепление):
CH3
CH2 OH
H2SO4 1800C
CH2
CH2
+ H2O
4. Перегруппировки
Перегруппировки сопровождаются изменением строения молекулы без изменения состава:
C6H5
C6H5
C
N
OH
H2SO4
t0
C6H5
NH C O
C6H5
5. Разложение
Разложение органического соединения протекает с разрушением углерод- ного скелета молекулы.
O O t0
C C
HO OH
O
CO2 + H C
OH
Органические реакции, как и неорганические, могут быть окислительно – восстановительными. Однако, в органической химии окислением считают такую реакцию, в которой органическое вещество соединяется с кислородом или теряет водород:
O
CH3 C
O
+ 2 [Ag(NH3)2]OH CH3 C +
2Ag + 4 NH3 + H2O
H
CH3 CH2 OH
+ CuO
OH
t0 O
CH3 C +
H
Cu + H2O
а восстановлением – такую реакцию, в которой органическое вещество присое- диняет водород:
O
CH3 C + H2
H
t0, p Ni
CH3 CH2 OH
3.2. Сопряженные системы. Ароматичность.
Сопряжением называют образование единого электронного облака из электронов нескольких π-связей или неподеленных электронных пар. Образова- ние единого электронного облака происходит при чередовании простых и крат- ных связей или атомов с неподеленными электронными парами, поэтому соеди- нения, в которых имеет место такое чередование, называют сопряженными со- единениями или сопряженными системами.
Сопряженные системы могут иметь открытую и замкнутую цепь сопря- жения.
Примером сопряженной системой с открытой цепью является бутадиен
– 1,3:

| H H |
| H |
| C |
| C |
| C |
| C |
| H |
H 39
В молекуле бутадиена-1,3 все атомы углерода находятся в состоянии sp2- гибридизации. Гибридные орбитали всех атомов углерода расположены в одной плоскости под углом 1200, т. е. молекула бутадиена-1,3 является плоской. За счет гибридных орбиталей атомы углерода образуют ζ-связи друг с другом и с ато- мами водорода. У каждого атома углерода остается по одной негибридизован- ной р-орбитали. Эти орбитали располагаются перпендикулярно плоскости моле- кулы и параллельно друг другу. При перекрывании орбиталей 1-го и 2-го, а так- же 3-го и 4-го атомов образуются две π-связи. Однако перекрываются также и орбитали 2-го и 3-го атомов, так как находятся у соседних атомов углерода. При этом образуется единое электронное облако, включающее электроны обеих π- связей и делокализованное (равномерно распределенное) по всей молекуле, т. е. образуется сопряженная система.
0,137 нм
0,137 нм
0,154 нм
СH3 СH3
H2C CH CH CH2 0,134 нм
0,147 нм
СH2 СH2
Сопряжение – энергетически выгодный процесс. При образовании единого электронного облака происходит дополнительное выделение энергии, и молеку- ла становится более устойчивой.
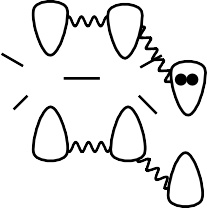
| H C C H H Cl |
В данном случае в образовании сопряженной системы принимают участие электроны двух π-связей, поэтому такой тип сопряжения называется π,π- сопряжением. В образовании сопряженной системы могут принимать участие также электроны свободных электронных пар. Такой тип сопряжения называется р,π-сопряжением. Примером р,π-сопряженной системы является хлорэтен (ви- нилхлорид):
В молекуле винилхлорида происходит перекрывание р-орбитали атома уг- лерода, участвующей в образовании π-связи, и р-орбитали атома хлора, ненесу-
щей неподеленную электронную пару. В результате образуется единое элек- тронное облако, включающее и электроны π-связи, и электроны свободной элек- тронной пары хлора.
| H |
| C |
| C |
| C |
| H |
| H |
 Примером сопряженной системы с замкнутой цепью сопряжения является бензол.
Примером сопряженной системы с замкнутой цепью сопряжения является бензол.
| C |
| C |
| C |
| H |
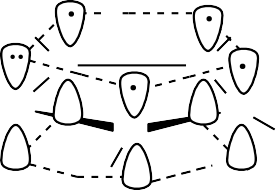
В молекуле бензола все атомы углерода находятся в состоянии sp2- гибридизации. За счет гибридных орбиталей атомы углерода образуют связи друг с другом и с атомами водорода. Так как все гибридные орбитали лежат в одной плоскости, молекула бензола является плоской. У каждого атома углерода остается по одной негибридизованной p-орбитали. Эти орбитали располагаются перпендикулярно плоскости молекулы и параллельно друг другу. Негибридизо- ванные p-орбитали перекрываются своими боками над и под плоскостью моле- кулы, причем каждая орбиталь перекрывается с двумя соседними. В результате образуется единое электронное облако, делокализованное (равномерно распре- деленное) по всему кольцу и включающее 6 π-электронов. При этом выделяется большое количество энергии, что делает бензол термодинамически очень ста- бильным. Образование сопряженной системы приводит к полному выравнива- нию длин углерод-углеродных связей, которые в бензоле равны 0,139 нм.
Строение бензола определяет его свойства – высокую устойчивость к дей- ствию окислителей, склонность к реакциям замещения (в которых сопряженная система сохраняется) и затруднения при протекании реакций присоединения ( в которых сопряженная система разрушается).
Совокупность свойств бензола, обусловленную его строением, принято на- зывать ароматичностью. Голландский ученый Э. Хюккель сформулировал кри- терии ароматичности, получившие название «правило Хюккеля». Согласно
этому правилу, ароматические соединения должны быть плоскими, цикли- ческими, содержать сопряженную систему, делокализованную по всему циклу и включающую 4n + 2 р- или π-электрона (где n – натуральное число, т. е. 0, 1, 2, 3 и т. д.)
Ароматическими могут быть не только карбоциклические, но и гетероцик- лические соединения. Например, к ароматическим гетероциклическим соедине- ниям относятся пиррол и пиридин.
| N |
| .H. N |
| H |
| C |
| C |
| C |
| C |
| H |

| H |
| C |
| C |
| H |
| . |
| N |
| C |
| C C |
| H |
| H |
H
пиррол пиридин

| -, |

| - |
системы участвуют не только
но и р-электроны (4
и 2 р-электрона).
3.3. Взаимное влияние атомов в молекуле
В химическую реакцию молекула органического соединения вступает не целиком, с реагентом взаимодействует только определенная часть молекулы. Эта часть молекулы называется реакционным центром. Наличие в молекуле реак- ционных центров и их природа зависит от распределения электронной плотности в молекуле. Распределение электронной плотности в молекуле определяется вза- имным влиянием атомов. Способы передачи взаимного влияния атомов могут быть различными, в органической химии их называют электронными эффек-
тами. Наиболее распространены и наиболее изучены два электронных эффекта:
индукционный (индуктивный) эффект и мезомерный эффект.
 Индукционный или индуктивный эффект (Iэф) - это смещение электрон- ной плотности по -связям или изолированным -связям. Это смещение вызвано различием в электроотрицательности атомов, образующих связь, или наличием на них полных или частичных зарядов.
Индукционный или индуктивный эффект (Iэф) - это смещение электрон- ной плотности по -связям или изолированным -связям. Это смещение вызвано различием в электроотрицательности атомов, образующих связь, или наличием на них полных или частичных зарядов.
Индукционный эффект может быть положительным (+I) или отрицатель- ным (− I). Отрицательный индукционный эффект проявляют атомы или группы атомов, которые притягивают к себе электронную плотность, понижая ее на ато- ме углерода. К таким заместителям относятся атомы с большей, чем у атома уг- лерода, электроотрицательностью, а также заместители, атомы которых имеют полный или частичный положительный заряд:
δ - δ -
+ O δ+ O
δ+ O
δ+ δ -
- OR, - NR2, - F, - Cl, - Br, - I, - SO3H, - N
,- C
O
- C
R , OR
, - CN и т. д.
Графически индукционный эффект изображают прямой стрелкой на месте соответствующей ζ-связи и направленной к тому атому, к которому смещаются электроны. Например, в молекуле хлорметана хлор проявляет отрицательный электронный эффект:
H
| C |
H Cl
H
Чем больше электроотрицательность атома, тем сильнее проявляемый им отрицательный индукционный эффект. Так, гидроксильная группа (ОН) прояв- ляет больший отрицательный индукционный эффект, чем аминогруппа (NH2), а в ряду галогенов сила отрицательного индукционного эффекта уменьшается от фтора к йоду. Заместитель, имеющий полный положительный заряд, проявляет более сильный отрицательный индукционный эффект, чем незаряженный. На- пример, аммониевая группа ( - NH3+) проявляет более сильный отрицательный
индукционный эффект, чем незаряженная аминогруппа ( - NH2). Чем больше частичный положительный заряд на атоме углерода заместителя, тем сильнее проявляемый отрицательный индукционный эффект. Так, карбонильная группа проявляет больший отрицательный индукционный эффект, чем карбоксильная, поскольку δ+ на атоме углерода карбонильной группы больше, чем в карбок- сильной.
δ -
δ+ O
- C
R
δ -
δ+ O
- C
OR
Положительный индукционный эффект проявляют заместители, которые подают электронную плотность на атом углерода (отталкивают электронную плотность от себя). К ним относятся заместители, электроотрицательность кото- рых меньше, чем у атома углерода, а также заместители, имеющие полный или частичный отрицательный заряд:
O , BR2, SiR3, Li, MgBr, HgCl
и т. д.
Следует отметить, что хотя водород имеет меньшую электроотрицатель- ность, чем углерод, его индукционный эффект принят равным нулю. Положи- тельный индукционный эффект проявляют также алкильные радикалы, причем, чем больший объем имеет радикал, тем сильнее проявляемый им положитель- ный индукционный эффект:
CH3
CH3 C CH3
CH3
CH
CH3
CH3 CH2
CH3
Индукционный эффект, как положительный, так и отрицательный, быстро
затухает по цепи и передается не более, чем на три связи:
δδδ+
δδ+ δ+ δ -


 CH3 CH2 CH2 Cl
CH3 CH2 CH2 Cl
Мезомерный эффект (Мэф) – это передача электронного влияния замести- теля на сопряженную систему, при этом заместитель сам становится частью со- пряженной системы.
Мезомерный эффект, как и индукционный, может быть положительным (+М) и отрицательным ( − М). Положительный мезомерный эффект проявляют заместители, которые повышают электронную плотность в сопряженной систе- ме. К ним относятся заместители, атомы которых, непосредственно связанные с сопряженной системой, имеют неподеленную электронную пару:
-NH2, -OH, -OR, -O C R, -Cl, -Br, -I
O
и т. д.

| δ - |
| δ+ |
| O H |
| δ - |
| δ - |
Например, в молекуле фенола электронная пара кислорода взаимодейству- ет с сопряженной системой бензольного кольца, образуя с ней единое электрон- ное облако (т. е. заместитель становится частью сопряженной системы).
δ+
При этом электронная пара кислорода смещается к бензольному кольцу (смещение электронов π-связей и свободных электронных пар обозначают изо- гнутой стрелкой), в результате чего электронная плотность в бензольном кольце повышается. Реакции электрофильного замещения, характерные для ароматиче- ских соединений, будут протекать легче, чем в незамещенном бензоле.
Влияние заместителя передается по всем сопряженным связям одинаково, т. е. их электроны смещаются в том же направлении, что и электроны заместите- ля. Это приводит к чередованию зарядов в сопряженной системе. Электронная плотность повышается в положениях 2,4,6 (о- и п-положениях) и понижается в положениях 3 и 5 (м-положениях). Действие электрофилов будет направлено на атомы с избытком электронной плотности, т. е. в положения 2,4,6. Заместители, облегчающие протекание реакций электрофильного замещения в бензольном кольце и направляющие их в положения 2,4,6 называются ориентантами I рода или о, п - ориентантами.
Помимо +М-эффекта гидроксильная группа, как известно, обладает –I- эффектом, за счет которого притягивает электронную плотность от бензольного кольца. Однако мезомерный эффект почти всегда проявляется сильнее, чем ин- дукционный, поэтому в результате совокупного действия –I и +М - эффектов электронная плотность в бензольном кольце будет повышаться. Заместители, ко- торые в результате совокупного действия всех своих эффектов повышают элек- тронную плотность на реакционном центре, называются электронодонорными. Если в результате совокупного действия всех своих эффектов заместители по- нижают электронную плотность на реакционном центре, то такие заместители называются электроноакцепторными.
Отрицательным мезомерным эффектом обладают заместители, понижаю- щие электронную плотность в сопряженной системе. К ним относятся замести- тели, атомы которых, непосредственно связанные с сопряженной системой, об- разуют также кратную связь с более электроотрицательным атомом:
O
-N , - S
O
O O
OH, - C O, - C
, - C N
И т. д.
O R OR
Например, в молекуле бензальдегида электроны π-связи карбонильной группы взаимодействуют с π-электронами бензольного кольца, образуя единое электронное облако, т. е. заместитель становится частью сопряженной системы. Входящий в эту систему атом кислорода притягивает к себе электронную плот- ность, обедняя ею бензольное кольцо:


| - |
| δ+ |
| C |
| δ+ |
| δ+ |
δ O
δ -
Понижение электронной плотности в бензольном кольце затрудняет взаи- модействие его с электрофилами. Как уже отмечалось, электронная плотность всех сопряженных связях смещается одинаково, в том же направлении, в каком








 она смещается в заместителе. Это, как и в случае +М-эффекта, приводит к чере- дованию зарядов. Электронная плотность наиболее сильно понижается в поло- жениях 2,4,6. В положениях 3 и 5 она тоже понижается, но в меньшей степени (можно считать, что относительно положений 2,4,6 она будет повышена). По- этому реакции электрофильного замещения будут протекать труднее, чем в не- замещенном бензоле, и будут направлены в положения 3 и 5 (м-положения). За- местители, затрудняющие протекание реакций электрофильного замещения в бензольном кольце и направляющие их в положения 3 и 5 называются ориен- тантами II рода или м-ориентантами.
она смещается в заместителе. Это, как и в случае +М-эффекта, приводит к чере- дованию зарядов. Электронная плотность наиболее сильно понижается в поло- жениях 2,4,6. В положениях 3 и 5 она тоже понижается, но в меньшей степени (можно считать, что относительно положений 2,4,6 она будет повышена). По- этому реакции электрофильного замещения будут протекать труднее, чем в не- замещенном бензоле, и будут направлены в положения 3 и 5 (м-положения). За- местители, затрудняющие протекание реакций электрофильного замещения в бензольном кольце и направляющие их в положения 3 и 5 называются ориен- тантами II рода или м-ориентантами.
Таким образом, направление реакций электрофильного замещения в бен- зольном кольце определяется природой заместителя.
| Направление атаки электро- фила, X – ориентант I рода. | Ориентанты I рода | Электронные эффекты |
| Е+ :X Е+ орто- орто-
пара-
Е+ электрофил | Все алкильные группы -СН3, -С2Н5 и т.д. | + Iэф |
| .. .. .. .. - ОН, -ОR, -SH, -NH2, .. .. .. .. -NHR, NR2, - Cl, - Br и др. | – I эф , + М эф |
| Направление атаки электрофила, X – ориентант II рода. | Ориентанты II рода | Электронные эффекты |
| X мета- мета- Е+ Е+ электрофил | О О С С ОН , Н , + О О N S ОН О- , O .. | – I эф , - М эф |
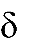

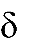
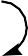
 Например:
Например:
OH
Br
+ 3 Br2
OH
Br
+ 3HBr
H O
C
Fe
+ Br2
Br
H O
C
+ HBr
Br
В случае наличия двух и более заместителей в бензольном кольце направ- ление действия заместителей может совпадать (согласованная ориентация), а может не совпадать (несогласованная ориентация). Если несогласованную ориентацию проявляют заместители разного рода, то направление атаки элек- трофила всегда определяет ориентант I рода.
Например:
Согласованная ориентация Несогласованная ориентация
Ориентант
II рода

HO δ
O

| O |
| δ - |
-
Ориентант
I рода
Ориентант


| + |
OH
δ - δ -
Ориентант I рода
H O C O H
δ - δ -
 δ -
δ -
E+ E+ E+ E+
салициловая (о-гидроксибензойная) м-гидроксибензойная кислота кислота
В тех случаях, когда несогласованную ориентацию проявляют заместители одного рода, общих закономерностей нет.
Примеры:
I. В каких соединениях имеет место сопряжение? Укажите тип со- пряжения:
а) СН3-СН=СН-СН2-СН=СН2; г) СН2=СН-ОСН3;
б) Br-СН2-CH=CH2; д) CH3CO-С6Н4-СН2-CH=CH-CHO. в) H2N-CH=CH-(NH2)C=NH;
а) СН3-СН=СН-СН2-СН=СН2
В этом соединении сопряжение отсутствует, так как двойные связи изоли- рованы (разделены более чем одной простой связью).
б) Br-СН2-CH=CH2
В данном соединении сопряжение также отсутствует, т.к. атом брома, имеющий неподеленную пару электронов, и двойная связь разделены двумя одинарными связями.
в) H2N-CH=CH-(NH2)C=NH
Напишем структурную формулу данного соединения:


| .. |
 NH
NH
H2N CH CH C
..
NH2
В данном соединении электроны π-связей отделены друг от друга и от электронов неподеленных электронных пар только одной простой связью, сле- довательно, образуется сопряженная система. Так как в образовании сопряжен- ной системы участвуют электроны двух π-связей и неподеленных электронных пар азота, имеет место как π,π-, так и р,π-сопряжение.
г) СН2=СН-ОСН3

 ..
..
CH2 CH O CH3
В данном соединении электроны свободной электронной пары кислорода отде- лены одной простой связью от π-электронов двойной углерод-углеродной связи. Следовательно, эти электроны образуют сопряженную систему и имеет место р,π-сопряжение.
д) CH3CO-С6Н4-СН2-CH=CH-CHO
Напишем структурную формулу данного соединения:
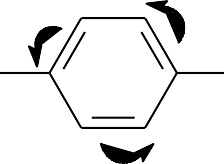
 H3C O
H3C O
| O |


 В молекуле этого соединения кетонная карбонильная группа непосредст- венно связана с бензольным кольцом. Электроны -связи кетонной карбониль- ной группы взаимодействуют с -электронами бензольного кольца и образуют единое электронное облако, т.е. сопряженную систему, при этом имеет место
В молекуле этого соединения кетонная карбонильная группа непосредст- венно связана с бензольным кольцом. Электроны -связи кетонной карбониль- ной группы взаимодействуют с -электронами бензольного кольца и образуют единое электронное облако, т.е. сопряженную систему, при этом имеет место
, -сопряжение. Альдегидная карбонильная группа также образует сопряжен- ную систему с двойной связью С – С, так как они разделены только одной про-

 стой связью ( , -сопряжение). Но между собой эти два сопряженных фрагмента молекулы не взаимодействуют, так как разделены двумя простыми связями.
стой связью ( , -сопряжение). Но между собой эти два сопряженных фрагмента молекулы не взаимодействуют, так как разделены двумя простыми связями.
II. Укажите электронные эффекты для всех функциональных групп, их электронодонорные и электроноакцепторные свойства:
- I, - M
 O - I
O - I
6 /QrH8d+z/qGXcfwBYNpIr5t59HMAAAAASUVORK5CYIJQSwECLQAUAAYACAAAACEAsYJntgoBAAAT AgAAEwAAAAAAAAAAAAAAAAAAAAAAW0NvbnRlbnRfVHlwZXNdLnhtbFBLAQItABQABgAIAAAAIQA4 /SH/1gAAAJQBAAALAAAAAAAAAAAAAAAAADsBAABfcmVscy8ucmVsc1BLAQItABQABgAIAAAAIQBa qksTxBsAAL+pAAAOAAAAAAAAAAAAAAAAADoCAABkcnMvZTJvRG9jLnhtbFBLAQItABQABgAIAAAA IQCqJg6+vAAAACEBAAAZAAAAAAAAAAAAAAAAACoeAABkcnMvX3JlbHMvZTJvRG9jLnhtbC5yZWxz UEsBAi0AFAAGAAgAAAAhAH3pg/XhAAAACQEAAA8AAAAAAAAAAAAAAAAAHR8AAGRycy9kb3ducmV2 LnhtbFBLAQItAAoAAAAAAAAAIQAfcfLD8QIAAPECAAAUAAAAAAAAAAAAAAAAACsgAABkcnMvbWVk aWEvaW1hZ2UxLnBuZ1BLBQYAAAAABgAGAHwBAABOIwAAAAA= ">  O S OH
O S OH
HO
CH2
- I, - M

 O
O
CH CH C
H
В данном соединении альдегидная группа и сульфогруппа проявляют от- рицательный мезомерный и отрицательный индукционный эффекты. Следова- тельно, они являются электроноакцепторными заместителями. Гидроксильная группа не участвует в образовании сопряженной системы и проявляет только от- рицательный индукционный эффект. Поэтому она также является электроноак- цептором.
III. Какие из приведенных соединений являются ароматическими? Дай- те объяснения.
| N |
Для каждого соединения проверим, выполняются ли критерии ароматич- ности.
а) Система циклическая, плоская, т.к. все атомы обоих циклов находятся в состоянии sp2 – гибридизации. В образовании сопряженной системы принимают участие 10 электронов, что соответствует формуле Хюккеля (4n + 2 = 10) для n =
2. Сопряженная система делокализована по всей молекуле. Следовательно, со- единение ароматическое.
б) Система циклическая, плоская, содержит сопряженную систему из 3-х двойных связей. Эта система содержит 6 π- электронов, что соответствует фор- муле Хюккеля (4n+2) для n=1. Однако в данном случае в образовании сопряжен- ной системы принимают участие не все атомы цикла – один из атомов является насыщенным и находится в состоянии sp3-гибридизации. Следовательно, данное соединение не является ароматическим.
в) Система циклическая, неплоская, все атомы цикла находятся в sp2 – гиб- ридном состоянии. В состав молекулы входят 8 π-электронов, что не соответст- вует формуле Хюккеля (4n + 2) ни одного из натуральных чисел. Следовательно, соединение не является ароматическим.
Вопросы для самоконтроля:
1. Что такое субстрат и реагент?
1. Какие способы разрыва ковалентной связи вам известны? Чем они разли- чаются?
2. Дайте определения понятиям: электрофил, нуклеофил, свободный радикал.
3. По каким признакам классифицируются органические реакции? Приведите примеры различных типов органических реакций.
4. Что такое сопряженные системы? Какие виды сопряжения вы знаете? При- ведите примеры.
5. Что такое ароматичность? Каковы условия ароматичности?
6. Примеры ароматических систем.
7. Что такое положительный индуктивный эффект? Приведите примеры.
8. Что такое отрицательный индуктивный эффект? Приведите примеры.
9. Что такое положительный мезомерный эффект? Приведите примеры.
10. Что такое отрицательный мезомерный эффект? Приведите примеры.
11. Какие заместители называют электронодонорными и электроноакцептор- ными? Приведите примеры.
12. Приведите примеры ориентантов I и II рода. Какое влияние оказывают они на протекание реакций электрофильного замещения?
13. Что такое согласованная и несогласованная ориентация? Приведите при- меры.
Упражнения для самостоятельной работы студентов
1. Укажите, какие из ниже приведенных соединений являются ароматиче- скими? Дайте пояснения.
OH
а) б)
в) г) O O C
| N |
2. В каких случаях имеет образование сопряженной системы? Укажите тип сопряжения:
а)
CH2 OH
в) O
CH3 C
Cl
б) г)
N H
HOOC
CH2 NH2
3. В приведенных ниже соединениях укажите электронные эффекты для всех функциональных групп, их донорные или акцепторные свойства:
а) HOOC CH CH
OH OH
COOH
в) CH3 CH CN
CH3
б)
CH2 NH2
O
г) HS CH2 CH2 C
H
Рекомендуемая литература:
1. Биоорганическая химия. Учебник. /Тюкавкина Н.А., Бауков Ю.И., С.Э. Зу- рабян. – М: ГЭОТАР-Медиа, 2012. – 416 стр., ил.
Глава 2, стр. 29-46
2. Биоорганическая химия: руководство к практическим занятиям: учеб. По- собие для студентов мед. Вузов / по ред. Н.А. Тюкавкина – М.: ГЭОТАР- Медиа, 2010. – 168 с.
3. Химия: учебник.-2-ое изд., испр. и доп./С.А. Пузаков – М: ГЭОТАР - Ме- диа, 2006.-640 стр.
Глава 6, стр. 69-85
|
из
5.00
|
Обсуждение в статье: КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ. ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В МОЛЕКУЛАХ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

