 |
Главная |
Электронное строение фенола.
|
из
5.00
|
В молекуле фенола бензольное кольцо и гидроксильная группа (-ОН) взаим- но влияют друг на друга. Неподеленная пара электронов атома кислорода гидро- ксильной группы находится в сопряжении ( р, π-типа) с бензольным кольцом. То есть в феноле гидроксильная группа, помимо отрицательного индуктивного эффек- та проявляет положительный мезомерный эффект.
-I, +M- эффекты


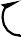
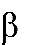
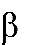
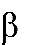
| O |
| H |
Величина положительного мезомерного эффекта больше, чем отрицательно- го индуктивного, поэтому гидроксильная группа оказывает донорное действие на бензольное кольцо. Вследствие этого электронная плотность в кольце перераспре- деляется и повышается особенно в орто- и пара-положениях по отношению к гидроксогруппе. В этих положениях возникает частичный отрицательный заряд, что облегчает реакции электрофильного замещения.
Величина электронной плотности на атоме кислорода за счет донорного эф- фекта понижается, полярность связи О – Н повышается, что увеличивает подвиж- ность атома водорода и кислотные свойства фенола по сравнению со спиртами.
Условно химические свойства фенола можно представить схемой:
основные свойства, нуклеофильные свойства
 электрофильное замещение водорода в кольце
электрофильное замещение водорода в кольце
O H
кислотные свойства нуклеофильное замещение
(реакции затруднены)
Химические свойства.
Химические свойства фенолов обусловлены наличием группы ОН и бен- зольного кольца и их взаимным влиянием.
1. Кислотно-оснóвные свойства.
Фенол, как и спирты проявляет слабые амфотерные свойства, с преобла- данием кислотных. Фенол диссоциирует в растворе с образованием фенолят- иона:
OH O-
+ H+
фенолят-ион
Взаимодействие с активными металлами и щелочами приводит к образо- ванию солей - фенолятов (кислотные свойства):
OH ONa
+ 2 Na, - H2
+ NaOH, -H2O
фенолят натрия
Образующиеся феноляты легко разлагаются при действии кислот. По- этому при действии угольной кислоты (СО2 + Н2О) и других кислот феноляты легко разлагаются и обратная реакция не возможна.
 С6Н5ОNа + СО2 + Н2О С6Н5ОН + NаНСО3
С6Н5ОNа + СО2 + Н2О С6Н5ОН + NаНСО3
Фенолы реагируют с солями (хлоридом железа (III)). Данная реакция яв- ляется качественной реакцией на фенольный гидроксил:
3С6Н5ОН + FеСl3 (С6Н5О)3Fе + 3НСl
фиолетовое окрашивание
Каждый фенол дает свое характерное окрашивание в качественной реак- ции - фенол и резорцин - фиолетовое, пирокатехин и гидрохинон – зеленое, пи- рогаллол – красное.
 Взаимодействие с сильными кислотами (основные свойства).
Взаимодействие с сильными кислотами (основные свойства).
Фенол в присутствии сильных кислот так же присоединяет протон и об- разуется неустойчивый фенилоксониевый ион:
H
 OH O H
OH O H
+ HCl Cl
хлорид фенилоксония
|
из
5.00
|
Обсуждение в статье: Электронное строение фенола. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

