 |
Главная |
Электронное строение спиртов
|
из
5.00
|
окисление
H
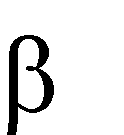
R CH CH
основные свойства,
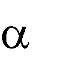


 нуклеофильные свойства
нуклеофильные свойства
кислотные свойства
O H
H
дегидратация
нуклеофильное замещение
Химические свойства спиртов обусловлены их электронным строением. В моле- куле спирта кислород, как более электроотрицательный атом, тянет на себя электрон- ную плотность от атомов углерода углеводородного радикала и от водорода. При этом связи С – О и О – Н поляризуются и на атомах углерода и водорода возникают частично положительный (δ+), а на атоме кислорода частично отрицательный (δ-) заряды. Полярность связи О – Н определяет еѐ склонность к гетеролитическому разрыву. Таким образом, атом водорода становится подвижным и способен отщеп- ляться в виде протона (Н+). Следовательно, спирты проявляют свойства ОН-кислот. В то же время у кислорода имеется неподелѐнная донорная электронная пара и спирты проявляют основные свойства. Поэтому можно сказать, что спирты являются
амфотерными соединениями. За счет поляризации связи С – О возможен гетеролити- ческий разрыв и для спиртов характерны реакции нуклеофильного замещения (SN).
Химические свойства
1. Кислотно-оснóвные свойства.
Спирты – слабые амфотерные соединения.
 Взаимодействие с активными металлами приводит к образованию солей спиртов- алкоголятов (кислотные свойства):
Взаимодействие с активными металлами приводит к образованию солей спиртов- алкоголятов (кислотные свойства):
2С2H5–ОН + 2Nа
С2H5–ОNа + Н2
| 2 |
Алкоголяты легко гидролизуются, это доказывает что спирты более сла- бые кислоты, чем вода и равновесие в реакции со щелочами смещено в сторону исходных веществ.
 С2H5– ОNа + НОН С2H5–ОН + NаОН
С2H5– ОNа + НОН С2H5–ОН + NаОН
Кислотность алканолов уменьшается с увеличением длины углеводород- ного радикала из-за увеличения донорного эффекта радикала. В ряду первич- ные – вторичные - третичные спирты та же уменьшается.
 Взаимодействие с сильными кислотами (основные свойства).
Взаимодействие с сильными кислотами (основные свойства).
Оснóвным центром в спиртах является атом кислорода, обладающий не- поделѐнной парой электронов. При действии на спирты сильными кислотами происходит присоединение Н+ к атому кислорода группы с образованием до- норно-акцепторных связей и образуется неустойчивый алкилоксониевый ион:
+ -
CH3 - CH2 - OH + HCl [C2H5 - O - H]Cl
H
этилоксоний хлорид
2. Реакции с разрывом связи О-Н.
К наиболее характерным реакциям гидроксисоединений, идущим с раз- рывом связи О–Н, относятся:
 реакции замещения атома водорода на металл (кислотные свойст- ва, смотри выше);
реакции замещения атома водорода на металл (кислотные свойст- ва, смотри выше);
 реакции замещения атома водорода на остаток кислоты (образо- вание сложных эфиров)
реакции замещения атома водорода на остаток кислоты (образо- вание сложных эфиров)
1) Реакции взаимодействия спиртов с органическими и минеральными кислотами (реакция этерификации):
CH3
O
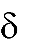
| 2 4 |
t0, H SO
CH3
C + H2O
| O |
H3C
O H + HO
NO2
метиловый эфир
уксусной кислоты (метилацетат)
t0
CH3 O NO2 + H2O
метиловый эфир
азотной кислоты (метилнитрат)
В этих реакциях спирт выступает в роли нуклеофильного реагента.
Сложные эфиры так же получают при реакции спиртов с производными карбоновых кислот (реакция ацилирования):
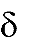
| O |
CH3 C + X
O CH3 H
CH3 C
+ HX
O CH3
X= Hal галогенангидрид
X=OR сложный эфир
X= OCOR ангидрид
2) Реакции замещения атома водорода на углеводородный радикал (реакция алкилирования, образование простых эфиров)
Реакция алкилирования - замещение водорода на углеводородный ради- кал, протекает под действием галогеналканов.
CH3 OH + Cl CH3 CH3 O CH3 + HCl
диметиловый эфир
3) Реакции отщепления водорода при окислении и дегидрировании.
Реакции дегидрирования протекают при пропускании паров спирта при 3000 С над медным катализатором. При этом первичные спирты образуют аль- дегиды, вторичные - кетоны, а третичные спирты в этих условиях подвергаются дегидратации.
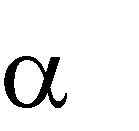
H3C CH O
t0, Cu
H3C CO
+ H2
этанол H H
этаналь H
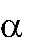 CH3
CH3
H3C C O
H H
t0, Cu
H3C C
O
CH3 + H2
пропанол-2 пропанон
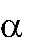 CH3
CH3
CH3
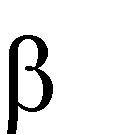
H2C C
t0, Cu
CH3
H2C C
CH3 + H2
H OH
2-метилпропен-2
2-метилпропанол-2
Реакции окисления спиртов проводят в различных условиях.
Окисление оксидом меди (II) протекает аналогично реакции дегидрирова- ния и приводит в случае первичных спиртов к образованию альдегидов, в слу- чае вторичных - кетонов, третичные спирты в этих условиях не окисляются.
| 0 |
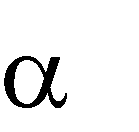
H3C CH
O + CuO t
H3C C
O + H2O
+ Cu
этанол H H
этаналь H
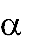 CH3
CH3
H3C C O
H H
+ CuO t
| 0 |
CH3 + H2O + Cu
пропанол-2 пропанон
Окисление спиртов более сильными окислителями – перманганатом ка- лия или дихроматом калия приводит к образованию соответствующих карбоно- вых кислот.
5CH3OH + 6KMnO4 + 9H2SO4 → 5CO2↑ + 6MnSO4 + K2SO4 + 19H2O
5C2H5OH + 4KMnO4 + 6H2SO4 → 5CH3COOH + 4MnSO4 + 2K2SO4 + 11H2O
3С2Н5ОН + 2K2Cr2O7 + 8H2SO4 → 3CH3COOH + 2Cr2(SO4)3 + 2K2SO4 + 11H2O
3. Реакции с разрывом связи С–О.
Реакция замещения OH-группы на галоген или другую нуклеофильную группу (RO–, NH2– и т.п.) протекает по механизму нуклеофильного замещения SN.
1) Галогенирование:
а) галогенирование происходит под действием хлороводорода

 СН3 СН2 - ОН + НСl СН3 СН2Сl + Н2О
СН3 СН2 - ОН + НСl СН3 СН2Сl + Н2О
хлорэтан
б) заместить гидроксильную группу на галоген легче при действии три- или пентахлорида фосфора, тионилхлорида (РСl3, РСl5 и SОСl2):
С2Н5ОН + РСl5 → С2Н5Сl + HCl + POCl3 С2Н5ОН + SOСl2 → С2Н5Сl + HCl + SO2
2) Получение простых эфиров:
В качестве нуклеофильного реагента выступает вторая молекула спирта.
В одной молекуле спирта разрывается связь С-О, а в другой О-Н.
CH3 OH + O CH3
H
t0, H2SO4
CH3 O CH3 + H2O
диметиловый эфир
Такую реакцию спиртов часто называют межмолекулярной дегидратацией.
3) Реакция дегидратации:
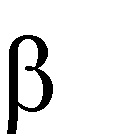 Реакция протекает при избытке Н2SО4 и более высокой температуре, чем в случае реакции образования простых эфиров:
Реакция протекает при избытке Н2SО4 и более высокой температуре, чем в случае реакции образования простых эфиров:
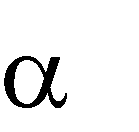
H2C CH2
t0, H2SO4
H2C CH2
+ H2O
H OH
этанол
этен
Межмолекулярная дегидратация протекает по правилу Зайцева: «При де- гидратации спиртов атом водорода отщепляется от соседнего наименее гидри- рованного β-углеродного атома»:
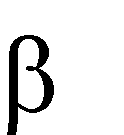
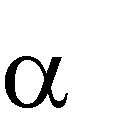
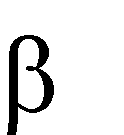
H3C CH CH
CH3
t0, H2SO4
H OH
бутанол-2
H3C CH CH CH3
бутен-2
+ H2O
Многоатомные спирты
Многоатомные спирты – это производные углеводородов, в которых не- сколько атомов водорода замещены на гидроксильные группы (-ОН).
|
из
5.00
|
Обсуждение в статье: Электронное строение спиртов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

