 |
Главная |
Теоретический материал
|
из
5.00
|
Методические указания к выполнению практических работ
Тюмень
2020
Организация–разработчик: государственное автономное профессиональное образовательное учреждение Тюменской области «Тюменский колледж производственных и социальных технологий».
Разработчик:
Солодовникова Н. С., преподаватель
Рассмотрена ПЦК «Технология деревообработки»
Протокол №____________ от «____»__________20___г.
Председатель ПЦК Быкова Е.Л.
_________________
«Утверждаю»
Руководитель УМО
_____________ Т.С.Пащенко
«____»____________20____г.
Содержание
Пояснительная записка
Практическая работа №1 Расчеты по химическим формулам и уравнениям
Практическая работа №2 Периодический закон и периодическая система химических элементов Д.И. Менделеева и строение атома
Практическая работа №3 Электролитическая диссоциация. Составление схем электролиза
растворов солей. Решение расчетных задач на электролиз
Практическая работа №4 Окислительно-восстановительные реакции
Практическая работа №5 Химия металлов
Практическая работа №6 Качественный анализ органических соединений
Практическая работа №7 Получение этилена. Изучение его свойств
Практическая работа №8 Составление структурных формул спиртов, закрепление знаний
номенклатуры
Практическая работа №9 Закрепление и углубление знаний о строении, номенклатуре и
свойствах альдегидов. Выяснение взаимосвязи между строением и свойствами карбонильных соединений
Практическая работа №10 Решение задач на распознавание органических соединений
Практическая работа №11 Генетическая связь между классами органических и
неорганических соединений
Пояснительная записка
Сборник практических работ составлен в соответствии с рабочей программой по дисциплине «Химия».
Целью выполнения является:
- освоение знаний о современной естественно-научной картине мира и методах естественных наук; знакомство с наиболее важными идеями и достижениями естествознания, оказавшими определяющее влияние на развитие техники и технологий;
- овладение умениями применять полученные знания для объяснения явлений окружающего мира, восприятия информации естественнонаучного и специального (профессионально значимого) содержания, получаемой из СМИ, ресурсов Интернета, специальной и научно- популярной литературы;
- развитие интеллектуальных, творческих способностей и критического мышления в ходе проведения простейших исследований, анализа явлений, восприятия и интерпретации естественно-научной информации;
- воспитание убежденности в возможности познания законов природы и использования достижений естественных наук для развития цивилизации и повышения качества жизни;
- применение естественно - научных знаний в профессиональной деятельности и повседневной жизни для обеспечения безопасности жизнедеятельности; грамотного использования современных технологий; охраны здоровья, окружающей среды.
Сборник состоит из пояснительной записки, описаний практических работ, которые снабжены общими теоретическими сведениями, контрольными вопросами и заданиями в соответствии с программой, списка рекомендуемой литературы.
Сборник поможет в организации самостоятельной работы студентов в процессе практических занятий, а также студенты смогут пользоваться им при повторении изученного материала, подготовке к зачёту.
При выполнении практических работ следует обратить внимание на
требования к выполнению практической работы:
- Ответить на теоретические вопросы.
- Оформить задания в тетради для практических работ.
Форма отчётности:
При выполнении практической работы необходимо:
· Записать номер и тему занятия.
· Записать задание.
· Подробно описать выполнение работы.
· Ответить на вопросы для самоконтроля.
Практическая работа № 1
Тема: Расчеты по химическим формулам и уравнениям
Цель: Формирование у студентов умений решать качественные и расчетные задачи по химии (типовые и комбинированные), а также углубление и расширение знаний.
На выполнение практической работы отводится 4 часа.
Теоретический материал
С 1961 г. в нашей стране введена Международная система единиц измерения (СИ). За единицу количества вещества принят моль.
Моль - количество вещества системы, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько их содержится в 0,012 кг изотопа углерода 12С. Число структурных единиц, содержащихся в 1 моле вещества NА (число Авогадро), определено с большой точностью; в практических расчетах его принимают равным 6,02•1023 молекул (моль-1). Нетрудно показать, что масса 1 моля вещества (мольная масса), выраженная в граммах, численно равна относительной молекулярной массе этого вещества, выражаемой в атомных единицах массы (а.е.м.). Например, относительная молекулярная масса кислорода (Мr) - 32 а.е.м., а мольная масса (М) - 32 г/моль. Согласно закону Авогадро, в равных объемах любых газов, взятых при одной и той же температуре и одинаковом давлении, содержится одинаковое число молекул. Иными словами, одно и то же число молекул любого газа занимает при одинаковых условиях один и тот же объем. Вместе с тем, 1 моль любого газа содержит одинаковое число молекул. Следовательно, при одинаковых условиях 1 моль любого газа занимает один и тот же объем. Этот объем называется мольным объемом газа (V0) и при нормальных условиях (0 °С = 273 К, давлении 101,325 кПа = 760 мм рт. ст. = 1 атм) равен 22,4 дм3. Объем, занимаемый газом при этих условиях, принято обозначать через V0, а давление - через Р0.
Согласно закону Бойля-Мариотта, при постоянной температуре давление, производимое данной массой газа, обратно пропорционально объему газа: Р0/Р1 = V1/V0 или РV = const.
По закону Гей-Люссака при постоянном давлении объем газа изменяется прямо пропорционально абсолютной температуре (Т): V1/T1 = V0/T0 или V/T = const.
Зависимость между объемом газа, давлением и температурой можно выразить общим уравнением, объединяющим законы Бойля-Мариотта и Гей-Люссака: PV/T = P0V0/T0, где Р и V - давление и объем газа при данной температуре Т; P0 и V0 - давление и объем газа при нормальных условиях (н.у.).
Приведенное уравнение позволяет находить любую из указанных величин, если известны остальные.
Фактор эквивалентности (fэкв) (эквивалент) – число, показывающее какая доля частицы (атома, молекулы) этого вещества равноценна одному иону водорода (H+) в реакциях обмена или одному электрону в окислительно-восстановительных реакциях.
Молярная масса эквивалента – это масса одного моль эквивалента вещества, равная произведению фактора эквивалентности на молярную массу вещества.
Согласно закону эквивалентов: массы реагирующих веществ пропорциональны молярным массам эквивалента этих веществ.
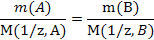
Молярная масса вещества, имеющего атомную или металлическую структуру, численно равна относительной атомной массе.
Ход выполнения практической работы:
|
из
5.00
|
Обсуждение в статье: Теоретический материал |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

