 |
Главная |
Строение атома углерода. Гибридизация.
|
из
5.00
|
Углерод. Символ С, элемент IVA группы 2-го периода Периодической системы элементов ; атомный номер 6; атомная масса 12,01115.
Электронная конфигурация в основном состоянии 1s22s22p2.
Углерод – особый элемент. Ни один другой химический элемент не способен образовывать такое многообразие соединений. Причина этого многообразия в том, что атомы углерода способны:
1) соединяться друг с другом в цепи различного строения – открытые (неразветвленные, разветвленные), замкнутые.
2) образовывать не только простые (одинарные), но и кратные (двойные, тройные) связи:
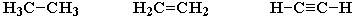
3) образовывать прочные связи почти с любым другим элементом.
Эти уникальные свойства углерода объясняются сочетанием двух факторов:
- наличие на внешнем энергетическом уровне (2s и 2p) четырех электронов (поэтому атом углерода не склонен ни терять, ни приобретать свободные электроны с образованием ионов);
- малый размер атома (в сравнении с другими элементами IV группы).
Вследствие этого углерод образует главным образом ковалентные, а не ионные связи, и проявляет валентность, равную 4.
Гибридизация. Атом углерода в возбужденном состоянии обладает четырьмя неспаренными электронами: одним s-электроном и тремя p-электронами — 1s22s22p3.
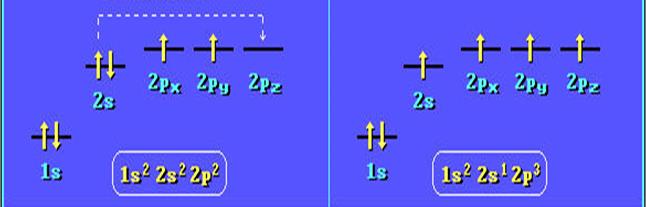
Гибридизация электронных орбиталей – это процесс их взаимодействия, приводящий к выравниванию по форме и энергии. Гибридные орбитали отталкиваются и располагаются на максимальном расстоянии друг от друга. Объяснение этого факта впервые было дано американским химиком Л. Полингом. Ввиду относительной близости значений энергии 2s- и 2р-электронов, эти электроны могут взаимодействовать между собой в ходе образования химической связи с электронами другого атома, давая четыре новых равноценных гибридных электронных облака.
1) sp3 – гибридизация. В процессе гибридизации принимает участие одна s и 3 p орбитали. Четыре совершенно одинаковые sp3-гибридные орбитали атома углерода расположены под углом 109,5° друг к другу и направлены к вершинам тетраэдра, в центре которого находится атом углерода .
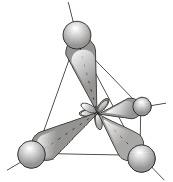
Это обусловливает более сильное перекрывание гибридных орбиталей с орбиталями электронов других атомов по сравнению с перекрыванием «обычных» s- и р-орбиталей и приводит к образованию более прочных связей.
2) sp2 – гибридизация. В этом случае при образовании соединений происходит гибридизация одной s- и двух р-орбиталей (sp2-гибридизация), при этом образуются три одинаковые sp2 - гибридные орбитали, расположенные под углом 120° друг к другу 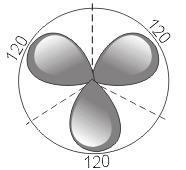 .
.
Посредством образования sp2-гибридных орбиталей как раз и объясняются структуры непредельных углеводородов с двойными связями. Например, для такой молекулы, как этилен, схематично можно изобразить следующую структуру 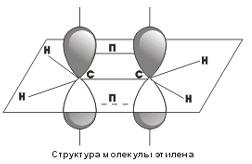 .
.
Как видно, у каждого атома углерода есть σ-связи, образованные sp2-гибридными облаками, кроме того, между атомами углерода образуется П-связь за счет перекрывания p-орбиталей. Таким образом, двойные углерод-углеродные связи состоят из одной σ- и одной П-связи.
3) sp – гибридизация. В этом случае при образовании соединений происходит гибридизация одной s- и одной р-орбитали. Эти две различные орбитали превращаются в две одинаковые гибридные орбитали (тип гибридизации - sp), направленные под углом 180° друг к другу, т.е. эти две связи имеют противоположное направление 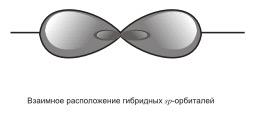 .
.
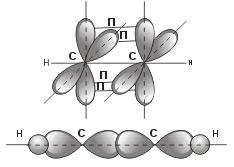
Остановимся подробнее на структуре молекулы ацетилена С2Н2. В молекуле ацетилена каждый атом углерода находится в sp-гибридном состоянии, образуя две гибридные связи, направленные под углом 180° друг к другу. Как в случае связей С-С, так и в случае связей С-Н возникает общее двухэлектронное облако, образующее σ-связи. σ-связью называют связь, возникающую при обобществлении электронных облаков двух атомов, если облака перекрываются по линии, соединяющей атомы.
Но в молекуле ацетилена в каждом из атомов углерода содержится еще по два р-электрона, которые не принимают участия в образовании σ-связей. Молекула ацетилена имеет плоский линейный «скелет», поэтому оба р-электронных облака в каждом из атомов углерода выступают из плоскости молекулы в перпендикулярном к ней направлении. При этом происходит также некоторое взаимодействие электронных облаков, но менее сильное, чем при образовании σ-связей. В итоге, в молекуле ацетилена образуются еще две ковалентные углерод-углеродные связи, называемые П-связями .
4. Основные положения теории строения Бутлерова.
1. Атомы в молекулах соединены друг с другом согласно их валентности, причем углерод всегда четырехвалентен, а его атомы способны соединятся в цепи линейного, разветвленного и замкнутого строения.
Молекулярные формулы показывают только, какие элементы и в каком соотношении входят в состав вещества (т. е. качественный и количественный элементный состав). Они в отличие от структурных формул не отражают порядка связывания атомов.
Структурная формула (формула строения) описывает порядок соединения атомов в молекуле, т. е. ее химическое строение. Химические связи в структурной формуле изображают черточками. Связь между водородом и другими атомами обычно не указывают (такие формулы называют сокращенными структурными). Примеры структурных формул некоторых органических соединений:
Линейные цепи – такие, в которых все атомы С располагаются на одной линии (прямой, ломаной или закрученной). Если атомы С обозначать точками, а химические связи между атомами черточками, то линейные цепи выглядят так:
 Разветвленные цепи – такие, в которых некоторые атомы С не попадают на непрерывную линию, соединяющую наибольшее число углеродных атомов молекулы. Примеры разветвленных углеродных цепей:
Разветвленные цепи – такие, в которых некоторые атомы С не попадают на непрерывную линию, соединяющую наибольшее число углеродных атомов молекулы. Примеры разветвленных углеродных цепей:
 Циклические цепи (циклы) содержат 3, 4, 5, 6 и большее число атомов С, замкнутых в кольцо. Примеры циклических цепей:
Циклические цепи (циклы) содержат 3, 4, 5, 6 и большее число атомов С, замкнутых в кольцо. Примеры циклических цепей:

|
2. Химические свойства определяются составом и строением его молекул.
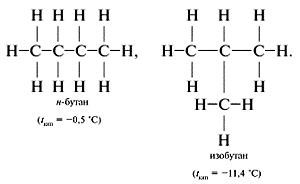
Вещества, имеющие одинаковый качественный и количественный состав, но различное химическое строении, называют изомерами. Явление существование изомеров, называют изомерией. Изомеры, имея одинаковый состав, но различное строение, различаются по свойствам.
Изомеры состава С4Н10:
 3. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы предвидеть свойства.
3. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы предвидеть свойства.
|
| 4. Атомы в молекулах оказывают друг на друга взаимное влияние, от которого зависят свойства веществ в целом. |
|
из
5.00
|
Обсуждение в статье: Строение атома углерода. Гибридизация. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

