 |
Главная |
Оксид меди (определение валентности)
|
из
5.00
|
Вычислить валентность меди (Cu) в составе оксида меди, в котором на 1 грамм кислорода приходится 3,97 грамм меди.
Решение задачи
Учитывая, что молярная масса эквивалентов кислорода (O) в составе оксида меди равна 8 г/моль, определим молярную массу эквивалентов меди (Cu) в составе оксида меди по закону эквивалентов:
Откуда выразим молярную массу эквивалентов меди (Cu) в составе оксида меди:
Получаем:
M экв (Cu) = 3,97 ∙ 8 / 1= 31,76 (г/моль).
Валентность меди (Cu) в оксиде меди находим из соотношения:
Mэкв(Cu) 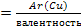
Отсюда:
валентность 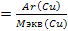
Получаем:
валентность = 63,55 / 31,76 = 2
Следовательно, металл – двухвалентная медь, оксид– оксид меди (II).
Ответ:
валентность меди равна 2.
2. Определить эквивалентную массу
Вычислить фактор эквивалентности и определить эквивалентную массу ортофосфорной кислоты (H3PO4) в реакциях образования гидрофосфата, дигидрофосфата и ортофосфата.
Решение задачи
Мэкв = М •fэкв
Фактор эквивалентности и эквивалентная масса вещества определяются той реакцией в которой данное вещество принимает участие, так как у одного и того же вещества в различных реакциях различны фактор эквивалентности и эквивалентная масса.
Запишем уравнения реакций образования
А. гидрофосфата
H3PO4 +2NaOH = Na2HPO4 +2H2O
Так как в одной молекуле ортофосфорной кислоты (H3PO4) замещается 2 атома водорода (H), следовательно, фактор эквивалентности (fэкв) ортофосфорной кислоты (H3PO4) равен 1/2:
f экв. (H3PO4) = 1/2
Учитывая, что молярная масса ортофосфорной кислоты (H3PO4) равна 98 г/моль (смотри таблицу Менделеева), определим эквивалентную массу ортофосфорной кислоты (H3PO4):
M ЭКВ ( H 3 PO 4 ) = 98• 1/2 = 49 (г/ моль)
Б. дигидрофосфата
H 3 PO 4 + NaOH = NaH 2 PO 4 + H 2 O
Так как в одной молекуле ортофосфорной кислоты (H3PO4) замещается 1 атом водорода (H), следовательно, фактор эквивалентности (fэкв) ортофосфорной кислоты (H3PO4) равен 1:
f экв. (H3PO4) = 1
Учитывая, что молярная масса ортофосфорной кислоты (H3PO4) равна 98 г/моль (смотри таблицу Менделеева), определим эквивалентную массу ортофосфорной кислоты (H3PO4):
M ЭКВ ( H 3 PO 4 )= 98 • 1 = 98 (г/моль)
В. ортофосфата
H 3 PO 4 +3 NaOH = Na 3 PO 4 +3 H 2 O
Так как в одной молекуле ортофосфорной кислоты (H3PO4) замещается 3 атома водорода (H), следовательно фактор эквивалентности (fэкв) ортофосфорной кислоты (H3PO4) равен 1/3:
f экв. (H3PO4) = 1/3
Учитывая, что молярная масса ортофосфорной кислоты (H3PO4) равна 98 г/моль (смотри таблицу Менделеева), определим эквивалентную массу ортофосфорной кислоты (H3PO4):
M ЭКВ ( H 3 PO 4 )= 98 • 1 /3= 32,667 (г/моль)
Ответ:
фактор эквивалентности ортофосфорной кислоты в реакции образования гидрофосфата равен 1/2, молярная масса эквивалента равна 49 г/моль;
фактор эквивалентности ортофосфорной кислоты в реакции образования дигидрофосфата равен 1, молярная масса эквивалента равна 98 г/моль;
фактор эквивалентности ортофосфорной кислоты в реакции образования ортофосфата равен 1/3, молярная масса эквивалента равна 32,667 г/моль.
3.Молярная масса эквивалента металла
При окислении 16,74 грамм двухвалентного металла образовалась 21,54 грамма оксида. Вычислите молярную массу эквивалента металла и его оксида. Чему равна атомная масса металла?
Решение задачи
Согласно закону эквивалентов: массы реагирующих веществ пропорциональны молярным массам эквивалента этих веществ.
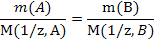
По условию задачи оксид образован двухвалентным металлом, следовательно, формулу запишем так MeO.
Исходя из массы оксида металла и массы металла, определим массу кислорода по формуле:
m (O) = m (MeO) – m (Me)
Получаем:
m (O) = 21,54 – 16,74 = 4,8 (г).
Закон эквивалентов в данном случае имеет вид:
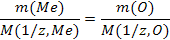
Из уравнения находим молярную массу эквивалента металла:
M (1/ z , Me ) 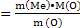
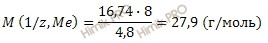
Рассчитаем молярную массу металла по формуле:
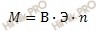
М – молярная масса,
В – валентность,
Э – эквивалентная масса
n – число атомов элемента в соединении.
Получаем:
M (Мe) = 2 ∙ 27,9 = 55,8 (г/моль).
Напомню, что молярная масса вещества, имеющего атомную или металлическую структуру, численно равна относительной атомной массе.
Следовательно, атомная масса металла равна 55,8 г/моль. А металл – железо (Fe).
Учитывая, что молярная масса оксида железа (FeO) равна 71,8 г/моль, найдем молярную массу эквивалента оксида железа (FeO) рассчитаем по формуле:
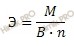
Получаем:
Э (FeO) = 71,8/2 = 35,9 (г/моль).
Ответ:
молярная масса эквивалента металла равна 27,9 г/моль;
атомная масса металла равна 55,8 г/моль;
молярная масса эквивалента оксида равна 35,9 г/моль.
4.Степень окисления в соединениях
Вычислите степень окисления свинца (Pb) в оксиде, в котором на 1 грамм свинца (Pb) приходится 0,1544 грамма кислорода (O).
Решение задачи
Учитывая, что молярная масса эквивалентов кислорода (O) равна 8 г/моль, определим молярную массу эквивалентов свинца (Pb) в оксиде по закону эквивалентов:
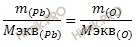
Откуда выразим молярную массу эквивалентов свинца (Pb) в оксиде:

Получаем:
M экв (Pb) = 1 ∙ 8/0,1544 = 51,8135 (г/моль).
Степень окисления в соединениях свинца (Pb) находим из соотношения:
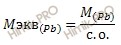
Отсюда:
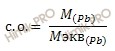
Получаем степень окисления в соединении:
с. о. = 207,2/51,8135 = 4
Ответ:
степень окисления свинца (Pb) в соединении равна 4.
Вопросы для самоконтроля
1. Какова мольная масса следующих веществ: HNO3, Al(OH)3, Cr2O3, FeSO4, K2SO4,
Na3PO4, NaCl,
K2CO3? Определите число молей, содержащихся в 200 г каждого вещества.
2. Выразите в молях: а) 6,02•1024 молекул метана; б) 1,8•1028 атомов хлора; в) 3,01•1023 молекул диоксида углерода; г) 30,1•1025 молекул фосфина; д) 19,6 г серной кислоты.
3. Сколько молекул содержит водород объемом 2 см3 (н.у.)?
4. Вычислите молекулярную массу газа, если относительная плотность его по воздуху равна 1,45.
5. Вычислите молекулярные массы газов, если: а) плотность газа по кислороду равна 0,50; б) плотность газа по азоту равна 0,93.
Практическая работа № 2
|
из
5.00
|
Обсуждение в статье: Оксид меди (определение валентности) |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

