 |
Главная |
Тема: Периодический закон и периодическая система химических элементов Д.И. Менделеева и строение атома.
|
из
5.00
|
Тема: Характеристика элементов с учётом местонахождения в Периодической системе. Составление электронных формул атомов элементов и графических схем, заполнения их электронами.
Цель работы:рассмотрение плана общей характеристики химического элемента; овладение умениями характеризовать химический элемент на основании его положения в Периодической системе Д.И. Менделеева; овладение навыками составления электронных формул и графических схем атомов элементов.
Пояснение к работе:
Повторите основные понятия и химические термины по учебному тексту. Рассмотрите примеры и правилами записи электронных формул атомов элементов и графических схем; план характеристики химического элемента и образец ответа. Далее приступайте к выполнению заданий.
Учебный текст:
Для полного описания состояния каждого электрона в атоме в квантово-волновой механике используются параметры п, l— квантовые числа.
Главное квантовое число (n) — это положительное целое число (1,2,3,4,... ∞), которое характеризует в основном энергию электрона, т.е. энергетический уровень.
Значение главного квантового числа также указывает на число энергетических подуровней, соответствующих данному уровню, - оно равно значению п.Таким образом, главное квантовое число определяет уровень электрона в атоме.
Орбитальное квантовое число (l) характеризует величину орбитального момента количества движения электрона, другими словами, уточняет энергетическое состояние электронов в пределах данного уровня, т. е. энергию подуровня.
Электроны, которые при движении образуют облако шаровой формы, принято называть s-электронами. Электронные облака называют также орбиталями.
Электроны, которые при движении образуют облака гантелеобразной формы, называют р-электронами.
Вращение электрона вокруг собственной оси называется спином{в пер. с англ.— веретено).
На одной орбитали может находиться лишь два электрона, обладающих противоположными (антипараллельными) спинами, т. е. один электрон как бы вращается вокруг оси по часовой стрелке, а другой — против часовой стрелки.
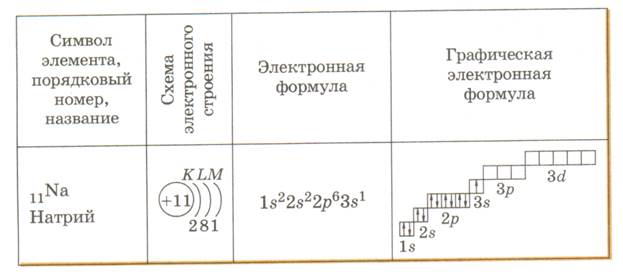
Пользуясь этими понятиями, расположение электронов в атомах изображают при помощи электронных формул, например Н — Is', Не — Is2, где цифра перед буквой показывает номер энергетического уровня, буква — форму электронного облака, а цифра справа над буквой— число электронов с данной формой облака. Клетка — орбиталь, стрелка — электрон, разнонаправленные стрелки — электроны с противоположными (анти-параллельными) спинами.
Энергетические уровни принято делить на подуровни. Группа делится на две подгруппы: главную и побочную.
К главным подгруппам относят те элементы, у которых очередные электроны (идущие по порядку) помещаются на s- и р-орбиталях. Это s- и р-электроны. В связи с этим и сами элементы главных подгрупп часто называют s и р-элементами.
К побочным подгруппам относят элементы, очередные электроны которых помещаются на d-орбиталях.
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы, делят на четыре электронных семейства или блока.
1) s-элементы; заполняется электронами s-подуровень внешнего уровня атома; к s-элементам относятся водород, гелий и элементы главных подгрупп I и II групп; число возможных электронов -2; графическое изображение – одна клетка.
2) р-элементы; заполняется электронами р-подуровень внешнего уровня атома; к р-элементам относятся элементы главных подгрупп III—VIII групп; число возможных электронов-6; графическое изображение – три клетки.
3) d-элементы; заполняется электронами d-подуровень предвнешнего уровня атома; к d-элементам относятся элементы побочных подгрупп I—VIII групп, их называют переходными элементами; число возможных электронов-10; графическое изображение – пять клеток.
4) f-элементы; заполняется электронами f-подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и актиноиды; число возможных электронов-14; графическое изображение – семь клеток.
Номер периода соответствует номеру внешнего уровня.
Число валентных электронов равно номеру группы.
Строение электронных оболочек атомов можно изображать с помощью энергетических или квантовых ячеек — записывают графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули, согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки (орбитали), располагаются в них сначала по одному и имеют при этом одинаковое значение. Сначала первым заполняется s-подуровень, вторым- p- подуровень, третьим – d-подуровень и четвёртым – f- подуровень (см. в таблице 1 и 2).
Таблица 1 Строение электронных оболочек атомов элементов второго периода
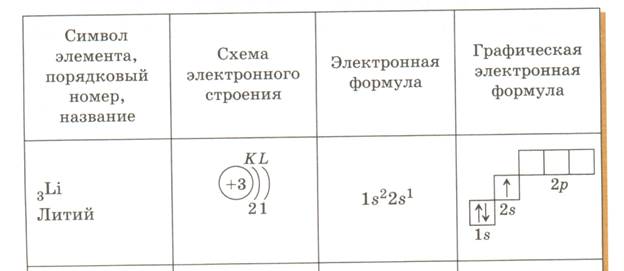
Таблица 2 Строение электронных оболочек атомов элементов третьего периода
План характеристики химических элементов.
1)Положение в периодической системе: порядковый номер, период, ряд, группа, подгруппа, относительная атомная масса.
2) Строение атома: заряд ядра; количество протонов, нейтронов, электронов; количество энергетических уровней и размещение на них электронов; формула электронной конфигурации — размещение электронов по подуровням; графическая формула расположения электронов; число электронов на последнем слое (металл или неметалл); высшая положительная степень окисления.
3) Формулы соединений: оксида, гидроксида (кислоты или основания), летучего водородного соединения (для неметаллов).
4) Химический характер элемента, его доказательство: кислотный (имеет кислотный оксид, который реагирует со щелочью с образованием соли и воды; кислотному оксиду соответствует кислота, взаимодействующая с основанием также с образованием соли и воды), основный (имеет основной оксид, которому соответствует основание; они реагируют с кислотой с образованием соли и воды), амфотерный (имеет оксид с соответствующим ему гидроксидом, которые реагируют и со щелочами, и с кислотами),
5) Сравнение с соседями: по периоду и по подгруппе (нужно помнить, что металл с неметаллами сравнивать нельзя).
Приведем пример характеристики химических элементов главных подгрупп на основании положения в периодической системе и строения атома.
Учитывая положение в периодической системе, дадим общую характеристику и укажем основные свойства фосфора.
Фосфор имеет порядковый номер 15, находится в третьем периоде, третьем ряду, главной подгруппе V группы периодической системы, относительная атомная масса 31. Ядро атома имеет заряд +15, состоит из 15 протонов и 31 - 15 = 16 нейтронов, вокруг ядра вращается 15 электронов, расположенных на трех энергетических уровнях, на внешнем уровне находится 5 электронов. Формула электронной конфигурации:
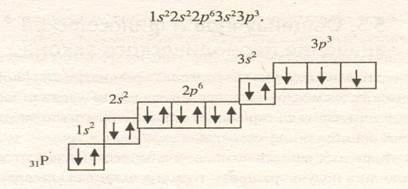
Наличие 5 электронов в наружном слое атома указывает, что это неметалл. Высшая положительная степень окисления элемента должна равняться 5. Формула высшего оксида Р2О5, кислоты — НРО3 (прибавляем Н2О к формуле оксида Р2О5, получаем Н2Р2О6, сокращаем индексы на 2), летучего соединения с водородом РН3.
Приведем доказательства кислотного характера оксида (Р2О5 или Р4О|0) и соответствующего ему гидроксида Р(НРО3):
Р4О10+ 12NaOH (разб.) = 4Na3PO4 + 6Н2О.
НРО3 + NaOH (конц.) = NaPO3 + Н2О.
Сравним Р с соседями по периоду (слева — кремний Si, справа — сера S) и подгруппе (сверху — азот N, снизу — мышьяк As).
Свойства любого элемента являются средними из свойств окружающих его соседей. Кремний, сера, азот и мышьяк — неметаллы. В периоде слева направо усиливаются неметаллические свойства и ослабевают металлические. Поэтому фосфор обладает более сильными неметаллическими свойствами, чем кремний, но более слабыми, чем сера. В главных подгруппах неметаллические свойства возрастают снизу вверх: азот — более сильный неметалл, чем фосфор; мышьяк— более слабый неметалл, чем фосфор.
Выполните задания по вариантам.
вариант -1
- Дайте характеристику химическому элементу Mg (магний) согласно плану.
- Напишите электронные формулы и графические электронные формулы для элементов: Cu, Zn, Mn
- Определите, какому химическому элементу соответствует заполнение электронами энергетических уровней: 2ē 8ē 18ē 2ē.
вариант-2
- Дайте характеристику химическому элементу P (фосфор) согласно плану.
- Напишите электронные формулы и графические электронные формулы для элементов: Cr, O, Cl
- Определите, какому химическому элементу соответствует заполнение электронами энергетических уровней: 2ē 8ē 18ē 5ē.
вариант-3
1. Дайте характеристику химическому элементу Сa (кальций) согласно плану.
2. Напишите электронные формулы и графические электронные формулы для элементов; К, F, S
3. Определите, какому химическому элементу соответствует заполнение электронами энергетических уровней: 2ē 8ē 13ē 2ē.
|
из
5.00
|
Обсуждение в статье: Тема: Периодический закон и периодическая система химических элементов Д.И. Менделеева и строение атома. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

