 |
Главная |
Применение электролиза.
|
из
5.00
|
1. Электролиз используется для получения многих активных металлов и неметаллов, щелочей и некоторых солей.
2. Электролизом пользуются в гальванопластике для покрытия изделий другим металлом: никелем, цинком, оловом, хромом, золотом и др.
3. С помощью электролиза получают сложные неорганические и органические соединения.
4. Электролиз используют для очистки некоторых металлов от примесей (рафинирование металлов).
Ход выполнения практической работы:
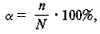
где 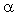 – степень диссоциации;
– степень диссоциации;
n – число диссоциированных молекул;
N – общее число молекул вещества в растворе.
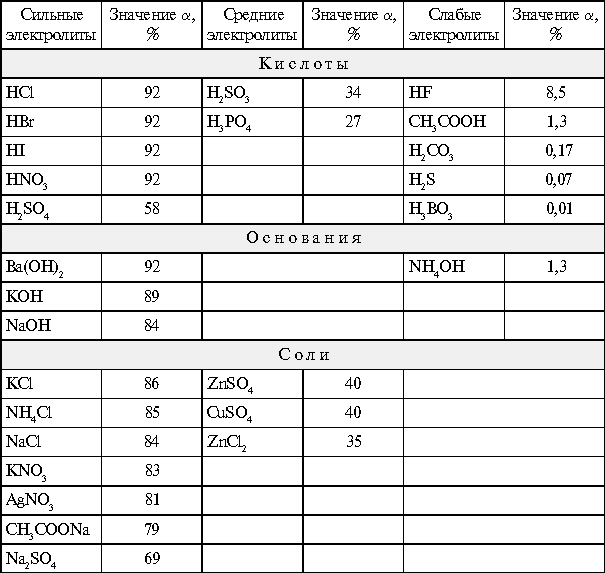
Для 0,1н. растворов электролитов при 18 °С значения степени диссоциации 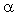 приведены в табл. 1.
приведены в табл. 1.
Степени диссоциации 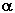 0,1н. растворов электролитов при 18 °С
0,1н. растворов электролитов при 18 °С
Таблица 1
Для диссоциации электролита AB:
AB 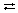 A+ + B–.
A+ + B–.
константа диссоциации Kдис более точно характеризует силу электролита, чем степеньдиссоциации 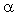 .
.
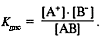
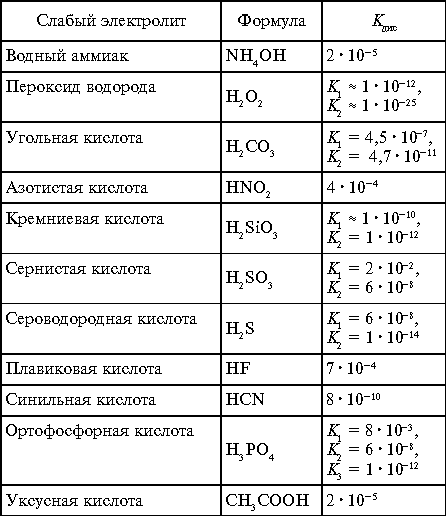
Если диссоциация электролита ступенчатая, то для каждой ступени выводится своя Kдис (табл. 2).
Константы диссоциации слабых электролитов
в водных растворах при 25 °С
Таблица 2
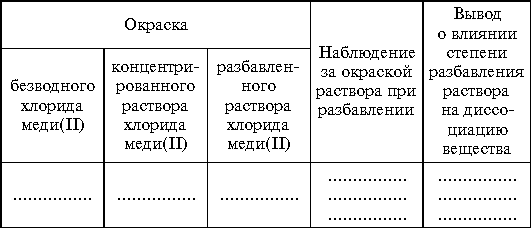
Задание 1. Рассмотреть представленные на демонстрационном столе водные растворы веществ. Заполнить таблицу.

Задание 2. Привести примеры окрашенных растворов веществ и указать, какими гидратированными ионами обусловливается их окраска.
БЕСЦВЕТНАЯ NaNO3 (Na+ – б/цв., 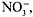 – б/цв.),
– б/цв.),
...................................................................................................
СИНЯЯ
...................................................................................................
РОЗОВАЯ
...................................................................................................
ЗЕЛЕНАЯ
...................................................................................................
ЖЕЛТАЯ
...................................................................................................
САЛАТОВАЯ
...................................................................................................
ФИОЛЕТОВАЯ
...................................................................................................
ОРАНЖЕВАЯ
...................................................................................................
ЖЕЛТО-БУРАЯ
...................................................................................................
Задание 3. Рассмотреть безводную хлорную медь(II). Растворить небольшое ее количество в 1–2 мл воды, затем постепенно (no каплям) разбавить раствор. Выпарить раствор, следить за изменениями окраски.
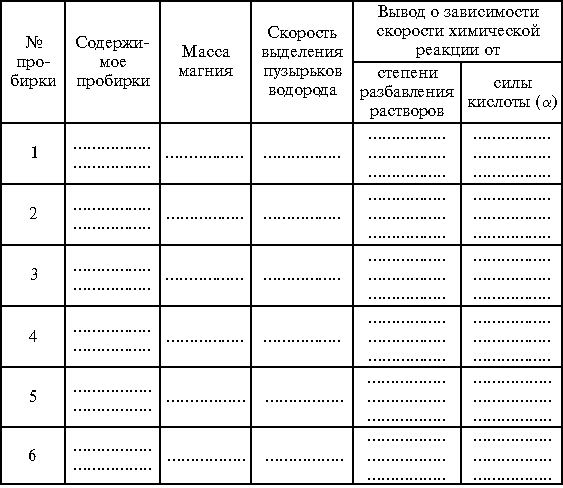
Задание 4. В первые три пронумерованные пробирки влить по 2 мл соляной кислоты ( 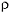 = 1,19 г/см3), в три другие – по 2 мл уксусной кислоты (
= 1,19 г/см3), в три другие – по 2 мл уксусной кислоты ( 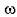 = 80%). В пробирки № 2 и 5 с соляной и уксусной кислотами соответственно прилить по 1 мл воды, в пробирки № 3 и 6 – по 2 мл воды. Затем во все пробирки присыпать по 1 г заранее приготовленных навесок магниевого порошка. Внимательно следить за признаками реакции и скоростью выделения водорода в каждой из пробирок.
= 80%). В пробирки № 2 и 5 с соляной и уксусной кислотами соответственно прилить по 1 мл воды, в пробирки № 3 и 6 – по 2 мл воды. Затем во все пробирки присыпать по 1 г заранее приготовленных навесок магниевого порошка. Внимательно следить за признаками реакции и скоростью выделения водорода в каждой из пробирок.
Задания по теме «Электролиз»
Задание № 1: Установите соответствие между формулой вещества и продуктом, который образуется на катоде в результате электролиза его раствора (для этого нужно во вторую колонку к вопросу передвинуть цифру, соответствующую правильному ответу:
| Формула вещества | Продукт электролиза |
| А) CuSO4 | 1) водород |
| Б) K2SO4 | 2) серебро |
| В) AgNO3 | 3) медь |
| Г) CuBr2 | 4) гидроксид калия |
| 5) кислород | |
| 6) оксид серы (IV) |
Сначала необходимо убрать заведомо неправильные ответы. Согласно правилам разрядки на катоде не могут выделяться кислород и оксид серы (IV). Затем, используя правила разрядки на катоде, выбираем правильные ответы.
Четыре человека последовательно рассматривают каждый случай, пишут схемы и выбирают правильный ответ:
А) CuSO4 – на катоде восстанавливается медь, т.к. этот металл находится в электрохимическом ряду напряжения металлов после водорода, поэтому на катоде восстанавливается сам металл – медь. Ответ – 3.
Б) K2SO4 – на катоде восстанавливается вода до водорода, т.к. калий – металл, который находится в электрохимическом ряду напряжения металлов до алюминия (включительно), поэтому на катоде первой восстанавливается вода. Ответ – 1.
В) AgNO3 - на катоде восстанавливается серебро, т.к. этот металл находится в электрохимическом ряду напряжения металлов после водорода, поэтому на катоде восстанавливается сам металл – серебро. Ответ – 2
Г) CuBr2, на катоде восстанавливается медь, т.к. этот металл находится в электрохимическом ряду напряжения металлов после водорода, поэтому на катоде восстанавливается сам металл – медь. Ответ – 3.
Запись на доске:
| 3 | 1 | 2 | 3 |
Задание № 2. Установите соответствие между формулой вещества и продуктом, который образуется на аноде в результате электролиза его раствора:
| Формула вещества | Продукт электролиза |
| А) CuSO4 | 1) фтор |
| Б) KCl | 2) бром |
| В) AgF | 3) хлор |
| Г) CuBr2 | 4) хлороводород |
| 5) кислород | |
| 6) оксид серы (IV) |
А) CuSO4 – на аноде, согласно правилу, первой будет окисляться вода до кислорода.
Ответ – 5.
Б) KCl - на аноде первым будет окисляться хлорид-ион до хлора. Ответ - 3
В) AgF – на аноде первой будет окисляться вода до кислорода. Ответ – 5.
Г) CuBr2 – на аноде первым будет окисляться бромид-ион до брома. Ответ – 2.
На доске появляются правильные ответы:
| 5 | 3 | 5 | 2 |
Вопросы для самоконтроля
1. Написать схемы электролиза растворов хлорида хрома (III), нитрата меди (II), фосфата калия, хлорида натрия и расплава иодида цинка.
2. Написать схемы электролиза растворов хлорида кальция, нитрата железа (III), сульфата калия, хлорида железа (II) и расплава хлорида железа (II).
3. Какая среда будет в водных растворах следующих солей: FеСlз, Li2СО3, MgS, NaCl. Напишите уравнения гидролиза в молекулярном и ионном виде.
4. При упаривании раствора хлорида натрия массой 500г с долей NaCl 1% получен новый раствор массой150 грамм. Какова массовая доля (в%) полученного раствора?
5. Как называется электрод, имеющий положительный заряд? (анод)
6. Как называется электрод, имеющий отрицательный заряд? (катод)
7. Чем отличается расплав соли от раствора? (в расплаве происходит диссоциация соли под действием высокой температуры, а в растворе диссоциация солей под действием воды).
8. Что произойдет с ионами соли при помещении в ее расплав электродов, подсоединенных к источнику тока?
9. Как записать этот процесс с помощью химических реакций?
|
из
5.00
|
Обсуждение в статье: Применение электролиза. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

