 |
Главная |
Теоретический материал
|
из
5.00
|
Общая формула алкенов: СnH2n.
Формулы этилена (этена)
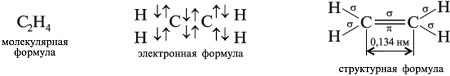
M(С2Н4) = 28 г/моль, VМ(С2Н4) = 22,4 л/моль, Dвозд(С2Н4) = 28/29 = 0,96.
Энергия связи атомов углерода:
Есв(С=С) = 587 кДж/моль,
Есв = 352 кДж/моль,
Есв = 235 кДж/моль.
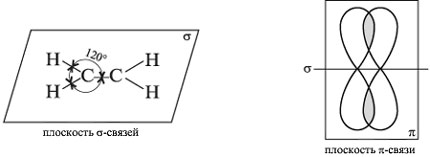
Перекрывание орбиталей атомов, связываемых -связями:
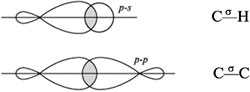
Прочность -связи меньше прочности -cвязи, т. к. «боковое» перекрывание орбиталей менее эффективно, чем «лобовое». А вот поляризуемость -связи выше, чем у -связи. В отличие от
-связи (С–С) -связь пространственно более доступна для электрофильной атаки.
Двойная связь в целом – место повышенной электронной плотности: в ней четыре электрона приходится на 0,134 нм, а у -связи – два электрона на 0,154 нм. Следовательно, -связь – самое реакционноспособное место в молекуле этилена.
Химические свойства алкенов
Для алкенов наиболее характерны реакции присоединения (галогенов, кислот, воды в присутствии кислот, водорода на катализаторах Pt или Ni). В ходе реакции под действием радикальных , а чаще электрофильных реагентов типа H+ -связь разрывается:
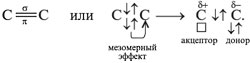
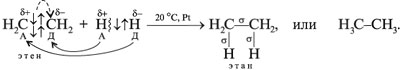
Ионы, в которых на атоме углерода имеется положительный заряд, – это карбокатионы.
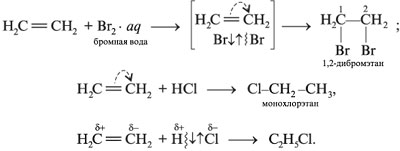
Гомологи этилена присоединяют галогеноводород согласно правилу Марковникова: водород галогеноводорода соединяется с наиболее гидрогенизованным атомом углерода алкена (т. е. содержащим больше атомов H).
При взаимодействии этилена с водой в присутствии концентрированной H2SO4 в зависимости от условий можно получить сложный эфир или спирт:
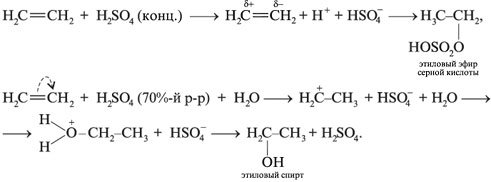
Cледовательно, H2SO4 является катализатором.
В промышленности гидратацией этилена получают этиловый спирт (этанол):
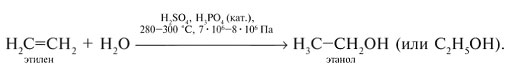
Особым случаем присоединения является полимеризация.
Если алкен реагирует с небольшим количеством концентрированной H2SO4, то карбокатион атакуется не (их мало), а другой молекулой алкена. В результате многократного присоединения образуется высокомолекулярное вещество – полимер (от греч. – многочисленный, – доля, часть):
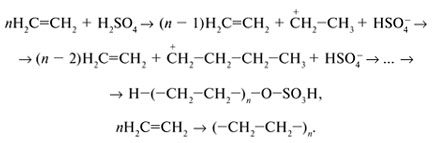
Реакцию соединения большого числа молекул (мономеров) в макромолекулы полимера называют полимеризацией.
Алкены легко окисляются по -связи. Обесцвечивание, а затем побурение раствора KMnО4 (подщелоченного содой) при пропускании через него алкена – качественная реакция на алкены:
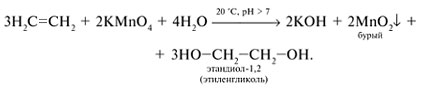
Этилен горит светящимся коптящим пламенем.
Физические свойства алкенов
По физическим свойствам алкены похожи на алканы (т. е. их молекулы тоже практически неполярны).
Получение алкенов
Алкены получают крекингом и дегидрированием алканов, отщеплением воды от спиртов, отщеплением галогеноводородов от алкилгалогенидов. Например:
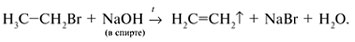
В промышленности алкены получают пиролизом ( 700 °С) алканов.
Применение алкенов
Присоединением к алкенам галогенов или галогеноводородов получают галогенопроизводные, используемые для синтеза более сложных веществ, а также в качестве растворителей
(СН2Cl–СH2Cl и др.).
Присоединением воды получают спирты R–OH.
Больше всего С2Н4 и С3Н6 идет на производство высокомолекулярных соединений – полимерных материалов.
Этилен – главное сырье современной химической отрасли промышленности – основного органического синтеза. Из этилена получают этиловый спирт, стирол, уксусный альдегид, винилхлорид, винилацетат, этиленоксид и другие соединения:
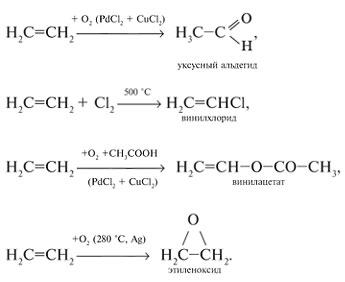
Этилен ускоряет созревание плодов, поэтому его добавляют в атмосферу теплиц.
Ход выполнения практической работы:
Получение этилена
Получите готовую реакционную смесь у учителя. Соберите прибор для получения газов.
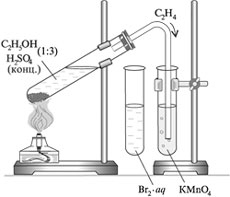
Осторожно, равномерно нагрейте смесь.
Внимание!!!
|
из
5.00
|
Обсуждение в статье: Теоретический материал |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

