 |
Главная |
Теоретический материал
|
из
5.00
|
Электролитическая диссоциация веществ
в водной среде

Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде или расплавлении.
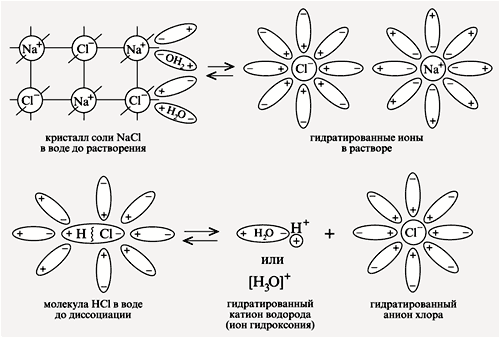
Основные положения теории электролитической диссоциации сформулированы в 1887 г. шведским ученым С.А.Аррениусом. Теория Аррениуса не учитывала роли молекул полярного растворителя в процессах диссоциации.
В гидратной теории, разработанной Д.И.Менделеевым и получившей дальнейшее развитие в трудах русских ученых И.А.Каблукова и В.А.Кистяковского, рассмотрен физико-химический процесс диссоциации электролитов в среде полярного растворителя.
Основные положения теории
электролитической диссоциации
1. Электролитам в водной среде (и в расплавленном состоянии) свойственно распадаться на положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы). Свойства ионов резко отличаются от свойств нейтральных атомов составляющих их элементов. Ионы в водных растворах гидратированны (аквакомплексы). Так, нейтральный атом натрия
+11Na 1s22s22p63s1
при обычных условиях легко отдает наружный (3s1) электрон (окисляется). Натрий бурно реагирует с водой, кислотами, химически активен.
Ион (катион) натрия
+11Na+ 1s22s22p6
не может отдавать электроны (окисляться), не реагирует с водой.
2. Беспорядочное (хаотичное) движение ионов в растворе под действием электрического поля становится направленным: положительно заряженные ионы (катионы) движутся к электроду с отрицательным зарядом (катоду), а анионы – к аноду. Этим объясняется ионная проводимость водных растворов и расплавов электролитов.
NaOH 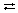 Na+ + OH–. Na+ + OH–.
| Гидpaтированныe анионы гидроксильных групп, двигаясь к аноду, окрашивают нейтральный (фиолетового цвета) лакмус в синий цвет. |
HCl 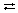 H+ + Cl–. H+ + Cl–.
| Катионы гидроксония H3O+, двигаясь к катоду, окрашивают лакмус в красный цвет. |
3. Процесс диссоциации электролитов в водной среде (расплавах) является обратимым:
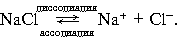
Электролиз.
Электролиз –окислительно-восстановительный процесс, происходящий на электродах под действием электрического тока. При пропускании электрического тока через растворы или расплавы электролитов, положительно заряженные ионы (катионы) перемещаются в направлении катода, отрицательно заряженные (анионы) – анода. На катоде происходит восстановление (приём электронов), на аноде – окисление (отдача электронов).
Электролиз расплавов солей
э.т.
2NaCl → 2Na + Cl2
Схема процессов, происходящих на катоде и аноде:
| К+ | : Na+ + 1ē = Na0 | восстановление |
| А- | : Cl- - 1ē = Cl0, Сl2↑ | окислитель |
Проблема: Какие продукты получаться при электролизе раствора хлорида натрия?
В отличие от расплава в растворе солей присутствуют и молекулы воды.
Рассмотрим процесс электролиза раствора хлорида натрия:
Какое явление происходит в растворе хлорида натрия под действием воды?
Диссоциация соли хлорида натрия на катионы натрия и анионы хлора.
NaCl → Na+ + Cl-
Составим схему процессов, происходящих на катоде и аноде:
| К+ | Na+, H2O | Na+, H2O + 1ē = Na0 | восстановление |
| А- | Cl- , H2O | Cl- - 1ē = Cl0, Сl2↑ | окислитель |
В данном случае, необходимо выбрать приоритетное вещество, то которое первым будет окисляться и восстанавливаться. Для этого существует правила, позволяющие выполнить эти действия.
Правило разрядки на катоде:
а) Если металл находится в электрохимическом ряду напряжения металлов до алюминия (включительно), то на катоде первой восстанавливается вода:
2H2O + 2ē = H2↑ + 2OH-, металл остается в виде иона.
б) Если металл находится в электрохимическом ряду напряжения металлов между алюминием и водородом, то на катоде восстанавливается металл и вода.
Ме +n + n ē = Me0,
2H2O + 2ē = H2↑ + 2OH-
в) Если металл находится в электрохимическом ряду напряжения металлов после водорода, то на катоде восстанавливается сам металл.
Ме+n + n ē = Me0
Рассмотрим наш пример: на катоде находится ион натрия (расположен в ряду активности до алюминия) и вода. Согласно правилу разрядки на катоде восстанавливается вода:
2H2O + 2ē = H2↑ + 2OH-
Ион натрия остается в растворе.
Правила разрядки на аноде:
Процесс на аноде зависит от материалов анода и от природы аниона. Если анод растворяется (железо, цинк, медь, серебро и т.д.), то окисляется металл анода, несмотря на природу аниона.
Если анод не растворяется (инертный), то:
а) Первыми на аноде окисляются бескислородные остатки кислот (I- , Br- , Cl- и т.д.)
Cl- - 1ē = Cl0, Сl2↑;
б) Затем вода (2H2O - 4ē = О2↑ + 4H+);
в) Следующие по очереди кислородсодержащие кислотные остатки и фторид-ион.
Рассмотрим наш пример: на аноде находятся ионы хлора и вода. Согласно правилу разрядки на аноде первой будет окисляться вода: 2H2O - 4ē = О2↑ + 4H+.
Анион хлора останется в растворе.
Подведем итог: в результате электролиза раствора хлорида натрия на катоде образуется газообразный водород, на аноде – газообразный кислород, в растворе находятся ионы: катионы натрия и анионы хлора.
Суммарное уравнение реакции: (схема демонстрируется на интерактивной доске):
э.т.
2NaCl + 2H2O → Н2 ↑ + Cl2 ↑ +2NaOH
|
из
5.00
|
Обсуждение в статье: Теоретический материал |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

