 |
Главная |
Теоретический материал
|
из
5.00
|
Моля́рный объём — объём одного моля вещества, величина, получающаяся от деления молярной массы на плотность. Характеризует плотность упаковки молекул.
Значение NA = 6,022…×1023 называется числом Авогадро в честь итальянского химика Амедео Авогадро. Это универсальная постоянная для мельчайших частиц любого вещества.
Именно такое количество молекул содержит 1 моль кислорода О2, такое же количество атомов в 1 моль железа (Fe), молекул в 1 моль воды H2O и т. д.
Важнейшей характеристикой раствора является содержание в нем растворенного вещества, которое называется концентрацией раствора. Концентрацию раствора выражают многими способами, но чаще всего применяются два способа.
1. Массовая доля растворенного вещества (w). Это отношение массы растворённого вещества к массе раствора. Например, 20%-й раствор гидроксида натрия – это такой раствор, в 100 кг (или г) которого содержится 20 кг (или 20 г) NaOH и 80 кг (или 80 г) воды.
Если растворенное вещество является жидким, то состав такого раствора может быть выражен не только в массовых, но и в объемных долях или объемных процентах. Объемная доля растворенного вещества (φ) – это отношение объема этого вещества к объему всего раствора. Например, если в 0,5 л раствора содержится 200 мл этанола, то его объемная доля равна 0,4, или 40 %.
2. Молярная концентрация (СМ) – это количество растворенного вещества в одном литре раствора. Например, в одном литре двумолярной (2 М) серной кислоты содержится 2 моль, то есть 196 г H2SO4, а в таком же объёме децимолярной (0,1 М) кислоты – 9,8 г H2SO4.
Плотность раствора отличается от плотности растворителя. Растворы неорганических соединений, молярная масса которых больше молярной массы воды (18 г/моль), имеют плотность больше плотности воды, причем с увеличением концентрации растворов их плотность увеличивается.
Взаимосвязь плотности и концентрации раствора выражается в виде таблиц; такая таблица имеется в справочнике, которым пользуются студенты (таблица ).
C концентрацией растворов связано много различных расчётов, которые проводятся не только в химии и химической технологии, но и в других областях техники, в которых применяются растворы.
Ход выполнения практической работы:
1. 2 г сплава меди с алюминием обработали раствором щелочи. Остаток растворили в разбавленной азотной кислоте, образовавшуюся при этом смесь выделили и прокалили. Масса остатка после прокаливания составила 0,8 г. Определите объем израсходованного 40%-го раствора гидроксида натрия (плотность 1,22 г/мл) и содержание металлов в сплаве.
Дано:
m (Cu+Al) = 1,2 г
m (остатка) = 0,8 г
ω (NaOH) = 40%
r (p-pa NaOH) = 1,22 г/мл
М (NaOH) = 40 г/моль
М (Cu) = 64 г/моль
М (Al) = 27 г/моль
М (CuO) = 80 г/моль
Найти :
V (p-pa NaOH)
ω (Cu)
ω (Al)
Решение:
Для решения задачи необходимо знать химические свойства меди и алюминия. Медь обладает металлическими свойствами и не реагирует со щелочами. С раствором гидроксида натрия будет реагировать только алюминий, который проявляет амфотерные свойства:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + H2 (1)
Остатком является медь, которую растворили в разбавленной азотной кислоте:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O (2)
После выделения и прокаливания смеси образуется оксид меди (II):
2Cu(NO3)2 = 2CuO + 4NO2 + O2 (3)
Определим массу меди в исходной смеси. Для этого найдем количество вещества оксида меди (II), по условию задачи его масса равна 0,8 г:
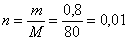 (моль).
(моль).
По уравнению (3) 2 моль оксида меди (II) образуется из 2 моль нитрата меди (II), (соотношение n(CuO) : n(Cu(NO3)2) = 1 : 1), следовательно, 0,01 моль оксида меди (II) образуется из 0,01 моль нитрата меди (II). По уравнению (2) из 3 моль меди дает 3 моль нитрата меди (II) (соотношение n(Cu) : n(Cu(NO3)2) = 1 : 1), тогда для образования 0,01 моль нитрата меди (II) необходимо 0,01 моль меди. Количество вещества меди равно 0,01 моль. Рассчитаем массу меди в исходной смеси:
m = n · M = 0,01 · 64 = 0,64 г.
По условию задача масса смеси равна 2 г, определим массу алюминия:
m(Al) = m(смеси) – m(Cu) = 2 – 0,64 = 1,36 (г).
Рассчитаем массовые доли металлов в смеси:
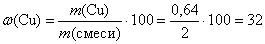 (%);
(%);
 (%).
(%).
Для определения объема израсходованного раствора гидроксида натрия, необходимо определить количество вещества NaOH вступившего во взаимодействие с алюминием. По уравнению реакции (1) 2 моль Al реагирует с 2 моль NaOH (соотношение n(Al) : n(NaOH) = 1 : 1). Количество вещества алюминий равно:
 моль,
моль,
следовательно, количество вещества n (NaOH) = 0,05 моль.
Определим массу гидроксида натрия:
m (в-ва) = n · M = 0,05 · 40 = 2 (г).
Вычислим массу раствора гидроксида натрия, зная массовую долю NaOH в растворе:
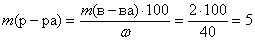 (г).
(г).
Определим объем раствора 40%-го раствора гидроксида натрия необходимый для взаимодействия:
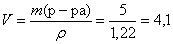 (мл).
(мл).
Ответ: V (p-pa NaOH) = 4,1 мл; ω (Cu) = 32%, ω (Al) = 68%.
2. При растворении 3 г сплава меди и серебра в концентрированной азотной кислоте получили 7,34 г смеси нитратов. Определите массовые доли металлов в сплаве.
Дано:
m (Cu+Ag) = 3 г
М (Cu) = 64 г/моль
М (Ag) = 108 г/моль
М (Cu(NO3)2) = 188 г/моль
М (AgNO3) = 170 г/моль
Найти:
ω (Cu)
ω (Ag)
Решение:
На примере решения данной задачи рассмотрим два способа решения задач на определение состава смеси.
Первый способ (алгебраический):
Запишем уравнения реакций растворения меди и серебра в концентрированной азотной кислоте:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O (1)
Ag + 2HNO3 = AgNO3 + NO2 + H2O (2)
Обозначим массу меди в сплаве – х г, а массу нитрата меди (II) – у г, тогда масса серебра в сплаве – (3 – х) г, а масса нитрата серебра – (7,34 – у) г.
По уравнению (1) количество вещества меди вступившего в реакцию равно количеству вещества нитрата меди (II) образовавшемуся в результате взаимодействия:
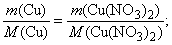
или 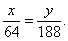
По уравнению (2) количество вещества серебра вступившего в реакцию равно количеству вещества нитрата серебра образовавшемуся в результате взаимодействия:
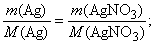
или 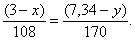
Получили систему уравнений с двумя неизвестными:
|
| 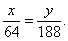
|
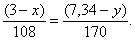
|
Решив систему уравнений методом подстановки, найдем значение х равное 1,92 г, то есть масса меди в сплаве равна 1,92 г. Тогда масса серебра составляет:
m (Ag) = m (сплава) – m (Cu) = 3 – 1,92 = 1,08 (г)
Рассчитаем массовые доли металлов в смеси:
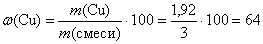 (%);
(%);
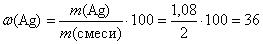 (%).
(%).
Ответ: ω(Cu) = 64%, ω(Al) = 36%.
Второй способ (мольный):
Запишем уравнения реакций растворения меди и серебра в концентрированной азотной кислоте:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O (1)
Ag + 2HNO3 = AgNO3 + NO2 + H2O (2)
Обозначим количество меди в сплаве – х моль, а количество серебра – у моль. Тогда масса меди будет равна 64х (m =n·M), а масса серебра 108у. По условию задачи масса сплава равна 3 г, следовательно:
64х + 108у = 3
По уравнению (1) количество вещества меди вступившего в реакцию равно количеству вещества нитрата меди (II) образовавшемуся в результате взаимодействия, тогда масса нитрата меди (II) равна 188х. По уравнению (2) количество вещества серебра вступившего в реакцию равно количеству вещества нитрата серебра образовавшемуся в результате взаимодействия, следовательно масса нитрата серебра равна 170у. По условию задачи масса смеси нитратов равна 7,34 г, поэтому:
188х + 170у = 7,34.
Получили систему уравнений с двумя неизвестными:
|
| 4х + 108у = 3 |
| 188х + 170у = 7,34 |
Решив систему уравнений методом подстановки, найдем значение у,равное 0,01 моль, масса серебра составляет:
m (Ag) = n (Ag) · M (Ag) = 0,01 · 108 = 1,08 (г).
Тогда масса меди равна:
m (Cu) = m (сплава) – m (Ag) = 3 – 1,08 = 1,92 (г).
Рассчитаем массовые доли металлов в смеси:
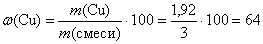 (%);
(%);
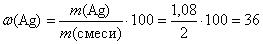 (%).
(%).
Ответ: ω(Cu) = 64%, ω(Al) = 36%.
Вопросы для самоконтроля
1. В порядке увеличения восстановительной способности металлы расположены в ряду:
1) K, Al, Cr, Sn
2) Sn, Cr, Al, Zn
3) Sn, Ca, Al, K
4) Au, Al, Ca, Li
2. Щелочные металлы
1)являются сильными восстановителями
2) проявляют как окислительные, так и восстановительные свойства
3) легко образуют отрицательно заряженные ионы
4) легко присоединяют электроны в химических реакциях
3. В ряду элементов: натрий -->магний -->алюминий
возрастает их
1) атомный радиус
2) восстановительная способность
3) химическая активность
4) электроотрицательность
4. У магния металлические свойства выражены
1) слабее, чем у бериллия
2) сильнее, чем у алюминия
3) сильнее, чем у кальция
4) сильнее, чем у натрия
5. В порядке уменьшения восстановительных свойств металлы расположены в ряду:
1) Al, Zn, Fe
2) Al, Na, K
3) Fе, Zn, Mg
4) Fe, Zn, Al
6. Наибольший радиус имеет атом
1) лития 2) натрия 3) кальция 4) калия
|
из
5.00
|
Обсуждение в статье: Теоретический материал |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы



